Pathologies auto-immunes : aspects épidémiologiques, diagnostiques et principes de traitement
![]() L’auto-immunité est naturelle chez tous les individus et s’intègre dans une réponse immune efficace et diversifiée. Pour autant, elle n’est pas synonyme de maladie auto-immune. Des mécanismes actifs de contrôle de l’auto-immunité permettent de limiter l’action toxique potentielle des cellules autoréactives. Ces mécanismes, s’ils sont dépassés ou dysfonctionnels, vont contribuer à une rupture de tolérance, laquelle peut se traduire, chez certains individus prédisposés génétiquement et par leur environnement (mode de vie, alimentation, expositions toxiques, etc.), par une authentique maladie auto-immune. On considère qu’il existe alors une réaction inappropriée du système immunitaire vis-à-vis des constituants du soi.
L’auto-immunité est naturelle chez tous les individus et s’intègre dans une réponse immune efficace et diversifiée. Pour autant, elle n’est pas synonyme de maladie auto-immune. Des mécanismes actifs de contrôle de l’auto-immunité permettent de limiter l’action toxique potentielle des cellules autoréactives. Ces mécanismes, s’ils sont dépassés ou dysfonctionnels, vont contribuer à une rupture de tolérance, laquelle peut se traduire, chez certains individus prédisposés génétiquement et par leur environnement (mode de vie, alimentation, expositions toxiques, etc.), par une authentique maladie auto-immune. On considère qu’il existe alors une réaction inappropriée du système immunitaire vis-à-vis des constituants du soi.
Principaux éléments permettant de définir une maladie auto-immune
La présence d’une biologie auto-immune isolée (par exemple, la positivité isolée d’une recherche d’anticorps antinucléaires) sans manifestation clinique, autre signe biologique ou anomalie sur une ou des imageries n’est pas suffisante pour définir une maladie auto-immune.
Les maladies auto-immunes (tableau 13.1) peuvent être schématiquement divisées en :
Certaines maladies auto-immunes peuvent s’associer entre elles : par exemple, polyarthrite rhumatoïde et maladie de Sjögren (secondaire), ou sclérodermie systémique et cirrhose biliaire primitive (syndrome de Reynolds), parfois dans le cadre des « polyendocrinopathies auto-immunes ». Une maladie auto-immune spécifique d’organe (telle qu’une thyroïdite) peut aussi apparaître des années avant une maladie systémique, témoignant alors d’un terrain dysimmunitaire.
Tableau 13.1. ![]() Classification des maladies auto-immunes.
Classification des maladies auto-immunes.
|
Maladies auto-immunes spécifiques d’organe |
Maladies auto-immunes non spécifiques d’organe (systémiques) |
|
– Glandes endocrines : – Foie et tube digestif : – Système nerveux : – Peau : – Cytopénies auto-immunes :
|
– Connectivites : –
|
![]() Leur prévalence est très variable d’une pathologie à l’autre mais, prises ensemble, elles concernent environ 10 % de la population des pays industrialisés ; ce chiffre est en constante augmentation au cours des dernières décennies.
Leur prévalence est très variable d’une pathologie à l’autre mais, prises ensemble, elles concernent environ 10 % de la population des pays industrialisés ; ce chiffre est en constante augmentation au cours des dernières décennies.
Selon la définition européenne, une pathologie est dite « rare » lorsque sa prévalence est inférieure à 50 pour 100 000 (0,05 %), c’est-à-dire lorsqu’elle touche moins de 1 personne sur 2 000 (voir item 22). C’est le cas de plusieurs maladies auto-immunes systémiques.
Il est classiquement admis que les maladies auto-immunes prédominent chez la femme jeune. Cependant, le sex-ratio et l’âge de début sont variables d’une maladie à l’autre.
Le tableau 13.2 résume ces données épidémiologiques. L’âge de début y est mentionné à titre indicatif, mais ces différentes maladies peuvent être diagnostiquées à n’importe quel âge.
Tableau 13.2. ![]() Prévalence et aspects épidémiologiques des principales maladies auto-immunes en France.
Prévalence et aspects épidémiologiques des principales maladies auto-immunes en France.
|
Prévalence |
Sex-ratio (F/H) |
Âge de début |
|
|
Maladies auto-immunes spécifiques d’organe |
|||
|
Thyroïdite de Hashimoto |
Non rare |
10:1 |
30 à 50 ans |
|
Maladie de Basedow |
7:1 |
||
|
Maladie d’Addison |
2:1 |
||
|
Cholangite biliaire primitive |
9:1 |
30 à 60 ans |
|
|
Maladie cœliaque |
2–3:1 |
Enfants et adultes jeunes |
|
|
Diabète de type 1 |
1:1 |
Enfants et adultes jeunes |
|
|
Myasthénie |
3:1 |
20 à 40 ans |
|
|
Sclérose en plaques |
3:1 |
||
|
Maladies auto-immunes systémiques |
|||
|
Polyarthrite rhumatoïde |
Non rare |
4:1 |
30 à 60 ans |
|
Lupus systémique |
Rare |
9:1 |
Femmes en âge de procréer |
|
Sclérodermie systémique |
4:1 |
30 à 60 ans |
|
|
Maladie de Sjögren |
9:1 |
||
|
Myosites inflammatoires |
1–2:1 |
||
|
Granulomatose avec polyangéite |
0,75:1 |
||
|
Polyangéite microscopique |
2:1 |
||
|
Granulomatose éosinophilique avec polyangéite |
0,6:1 |
||
Les maladies auto-immunes sont des pathologies multifactorielles, qui résultent de l’interaction complexe entre un terrain génétique à risque et des facteurs environnementaux favorisants.
Dans la majorité des cas, les maladies auto-immunes sont dites « polygéniques », car le terrain génétique favorisant ces maladies est déterminé par les polymorphismes de nombreux gènes ne conférant chacun qu’un surrisque faible à modéré de développer la maladie. Citons par exemple le rôle des gènes du HLA, du complément, des récepteurs des immunoglobulines, des gènes d’activation lymphocytaire et des voies de l’apoptose.
Le poids de la génétique est plus important dans les formes à révélation pédiatrique.
De très nombreux facteurs environnementaux pourraient jouer un rôle dans la survenue des maladies auto-immunes (tableau 13.3).
Tableau 13.3. ![]() Principaux facteurs environnementaux incriminés dans la survenue des maladies auto-immunes.
Principaux facteurs environnementaux incriminés dans la survenue des maladies auto-immunes.
|
Facteurs environnementaux |
Exemple d’association |
|
Agents physiques |
|
|
UV |
Association avec le lupus systémique |
|
Agents chimiques |
|
|
Tabagisme |
Association avec la PR, le lupus systémique |
|
Particules inhalées : silice (travailleurs du bâtiment, mineurs, prothésistes dentaires), poussières de l’industrie textile |
Associations rapportées avec la sclérodermie systémique, le lupus systémique et la polyarthrite rhumatoïde |
|
Médicaments : – doxycycline, triméthoprime-sulfaméthoxazole – bêtabloquants, certains antiépileptiques (carbamazépine), les anti-TNF, etc. |
À l’origine de lupus induit |
|
Agents infectieux |
|
| Virus : EBV, parvovirus B19, etc. |
Rôle suspecté dans le lupus |
|
Bactéries : Porphyromonas gingivalis, Chlamydiae, Campylobacter, etc. |
Rôle suspecté dans la polyarthrite rhumatoïde, les spondyloarthrites |
![]() En pratique, le diagnostic de maladie auto-immune repose sur l’association de manifestations cliniques et/ou biologiques évocatrices et la mise en évidence d’une auto-immunité (ou des stigmates biologiques de celle-ci).
En pratique, le diagnostic de maladie auto-immune repose sur l’association de manifestations cliniques et/ou biologiques évocatrices et la mise en évidence d’une auto-immunité (ou des stigmates biologiques de celle-ci).
Au cours de maladies auto-immunes spécifiques d’organe, les autoanticorps sont le plus souvent dirigés contre des antigènes spécifiques d’organe ou de tissu (pancréas, thyroïde, surrénale ou peau). Le tableau 13.4 résume les manifestations clinico-biologiques associées aux différentes maladies, mais une description plus approfondie est disponible dans les cours correspondant aux différents items.
Tableau 13.4. ![]() Caractéristiques cliniques et biologiques des maladies auto-immunes spécifiques d’organe.
Caractéristiques cliniques et biologiques des maladies auto-immunes spécifiques d’organe.
|
Maladie |
Principales manifestations cliniques et biologiques |
Autoanticorps associés |
Item |
|
Thyroïdite d’Hashimoto |
Signes d’hypothyroïdie (hypométabolisme) avec asthénie, bradycardie, constipation, somnolence, hypothermie avec frilosité, prise de poids modeste Augmentation de la TSH |
Anti- thyroperoxydase (TPO) et anti- thyroglobuline (TG) |
243 |
|
Maladie de Basedow |
Signes de thyrotoxicose avec nervosité, troubles du sommeil, tachycardie, tremblements, perte de poids, thermophobie, diarrhée Rétraction de la paupière supérieure avec asynergie oculopalpébrale, œdème palpébral, exophtalmie Signe de crise aiguë de thyroxique TSH effondrée |
Anti-récepteurs de la TSH (TRAK) |
242 |
|
Diabète de type 1 |
Soif, sécheresse buccale, polyurie, perte de poids, nausées, vomissements, douleurs abdominales, ± dyspnée, ± trouble de la conscience, ± déshydratation Hyperglycémie, ± cétonurie, ± bicarbonate < 18 mmol/l |
Anti-Glutamic Acid Decarboxylase (GAD), anti-Islet Antigen Number 2 (IA2), anti-îlots (ICA), anti-insuline (chez l’enfant), anti-ZnT8 |
247 |
|
Maladie de Biermer |
Anémie macrocytaire arégénérative, avec carence en vitamine B12 Gastrite atrophique Rarement sclérose combinée de la moelle |
Anti-facteur intrinsèque et anti-cellules pariétales gastriques |
213 |
|
Maladie cœliaque |
Diarrhée chronique Syndrome de malabsorption |
IgA anti-transglutaminases |
250 |
|
Myasthénie |
Fatigabilité excessive de la musculature, fluctuant dans le temps Ophtalmoplégie, ptosis et diplopie, faiblesse musculaire des membres, troubles de la déglutition |
Anti-récepteurs à l’acétylcholine (RACh) |
98 |
Les présentations cliniques et biologiques de ces maladies sont très hétérogènes. Toutefois, le tableau 13.5 résume les manifestations clinico-biologiques associées à certaines de ces maladies.
Tableau 13.5. ![]() Caractéristiques cliniques et biologiques des maladies auto-immunes systémiques.
Caractéristiques cliniques et biologiques des maladies auto-immunes systémiques.
|
Maladie |
Principales manifestations cliniques et biologiques |
Autoanticorps associés |
Item |
|
Polyarthrite rhumatoïde |
Polyarthrite symétrique et distale ± syndrome inflammatoire biologique (augmentation de la VS et de la CRP, anémie, thrombocytose…) |
Facteur rhumatoïde (FR) Anti-peptides citrullinés (CCP) ± Antinucléaires |
196 |
|
Lupus systémique |
Photosensibilité Éruption des zones photo-exposées Arthralgies inflammatoires, ± arthrites Sérite(s) Protéinurie Cytopénie(s) Hypocomplémentémie (diminution du CH50, des fractions C3 et C4) |
Antinucléaires (ou anti-noyaux) Anti-ADN natif Anti-Sm FR |
194 |
|
Syndrome |
Thromboses veineuses et artérielles Complications obstétricales Allongement du temps de céphaline activée (TCA) |
Antiphospholipides : anticoagulant circulant anticardiolipine et anti-bêta2-glycoprotéine de type I (β2GPI) |
194 |
|
Maladie de Sjögren |
Syndrome sec, notamment xérostomie et xérophtalmie Hypergammaglobulinémie polyclonale |
Antinucléaires de type anti-antigènes nucléaires solubles : anti-SSA ± anti-SSB FR |
|
|
Sclérodermie systémique |
Acrosyndromes, sclérodactylie, atteinte interstitielle pulmonaire, reflux gastro-œsophagien |
Antinucléaires Anti-topoisomérase I (Scl70) Anti-ARN polymérase 3 Anti-centromères |
239 |
| Vascularite à ANCA |
Arthromyalgies inflammatoires, purpura, dyspnée, toux, hypertension artérielle, rhinite, sinusite, polyneuropathie sensitive ou sensitivo-motrice, épisclérite ou sclérite Protéinurie, hématurie |
Anticorps anti-cytoplasme des polynucléaires neutrophiles (ANCA) de spécificité anti-protéinase 3 (PR3) ou anti-myéloperoxydase (MPO) |
193 |
Les maladies auto-immunes systémiques peuvent conduire à la défaillance des organes (tableau 13.6), ce qui constitue un critère de gravité. Ces atteintes peuvent parfois engager le pronostic vital et justifient alors d’un traitement plus intensif.
Aussi, tout diagnostic de maladies auto-immunes systémiques impose la recherche à l’interrogatoire, à l’examen clinique, en s’aidant éventuellement d’un bilan paraclinique, de manifestations viscérales (par exemple, atteinte du poumon dans la polyarthrite rhumatoïde, atteinte rénale dans le lupus systémique et certaines vascularites…).
Tableau 13.6. ![]() Principales atteintes caractérisant une maladie auto-immune « sévère ».
Principales atteintes caractérisant une maladie auto-immune « sévère ».
|
Type d’atteinte |
|
|
Rein |
Insuffisance rénale |
|
Poumon |
Pneumopathie interstitielle hypoxémiante, hémorragie alvéolaire par capillarite pulmonaire, etc. |
|
Système nerveux |
Atteinte du SNC par des mécanismes inflammatoires ou parfois ischémiques (notamment dans le cas du SAPL) ou du SNP en particulier par vascularite (mononévrites multiples) |
|
Cœur |
Myocardite |
|
Tube digestif |
Ischémie digestive, perforations |
|
Système hématopoïétique |
Syndrome d’activation macrophagique |
![]() Certains éléments biologiques aspécifiques peuvent se rencontrer chez les patients atteints de maladies auto-immunes.
Certains éléments biologiques aspécifiques peuvent se rencontrer chez les patients atteints de maladies auto-immunes.
Dans le contexte de maladies auto-immunes, cet examen peut retrouver le plus souvent :
Dans le contexte de maladies auto-immunes, on peut retrouver :
Celui-ci peut être mis en évidence par une augmentation de la protéine C-réactive (CRP) ou de la vitesse de sédimentation (VS).
Au cours du lupus systémique et de la maladie de Sjögren, il est décrit une dissociation entre la VS (augmentée) et la CRP (normale, sauf sérites et infections).
Dans certaines maladies auto-immunes, notamment systémiques, il peut être nécessaire de rechercher une atteinte rénale avec un dosage de la créatinémie, un ionogramme sanguin, la recherche d’une protéinurie et d’une hématurie.
Une augmentation des CPK et des ASAT peut témoigner d’une myolyse (par exemple, dans les myosites).
Le bilan hépatique peut être perturbé avec une cytolyse hépatique et/ou une cholestase.
Un allongement du temps de céphaline activée (TCA), avec un TP normal, est un critère diagnostique du syndrome des antiphospholipides.
![]() Les autoanticorps sont les principaux marqueurs immunologiques des maladies auto-immunes. Rappelons que la présence d’autoanticorps ne témoigne pas forcément de l’existence d’une maladie auto-immune, puisque toute stimulation du système immunitaire (par exemple, au cours de certaines infections) peut conduire à la formation d’autoanticorps.
Les autoanticorps sont les principaux marqueurs immunologiques des maladies auto-immunes. Rappelons que la présence d’autoanticorps ne témoigne pas forcément de l’existence d’une maladie auto-immune, puisque toute stimulation du système immunitaire (par exemple, au cours de certaines infections) peut conduire à la formation d’autoanticorps.
Les autoanticorps sont surtout utiles pour établir le diagnostic positif de maladie auto-immune ; seuls certains d’entre eux (par exemple, les anticorps anti-ADN natif et les ANCA) sont utiles pour le suivi des patients, car ils reflètent l’activité de la maladie. C’est aussi le cas de la consommation du complément au cours du lupus systémique.
En présence de manifestations cliniques et/ou biologiques évocatrices, la mise en évidence d’anticorps antinucléaires oriente plus particulièrement vers la famille des connectivites.
La recherche des anticorps antinucléaires repose sur une stratégie en deux étapes (tableau 13.7) :
Fig. 13.1. ![]() Recherche d’anticorps antinucléaires : principaux aspects en immunofluorescence indirecte.
Recherche d’anticorps antinucléaires : principaux aspects en immunofluorescence indirecte.
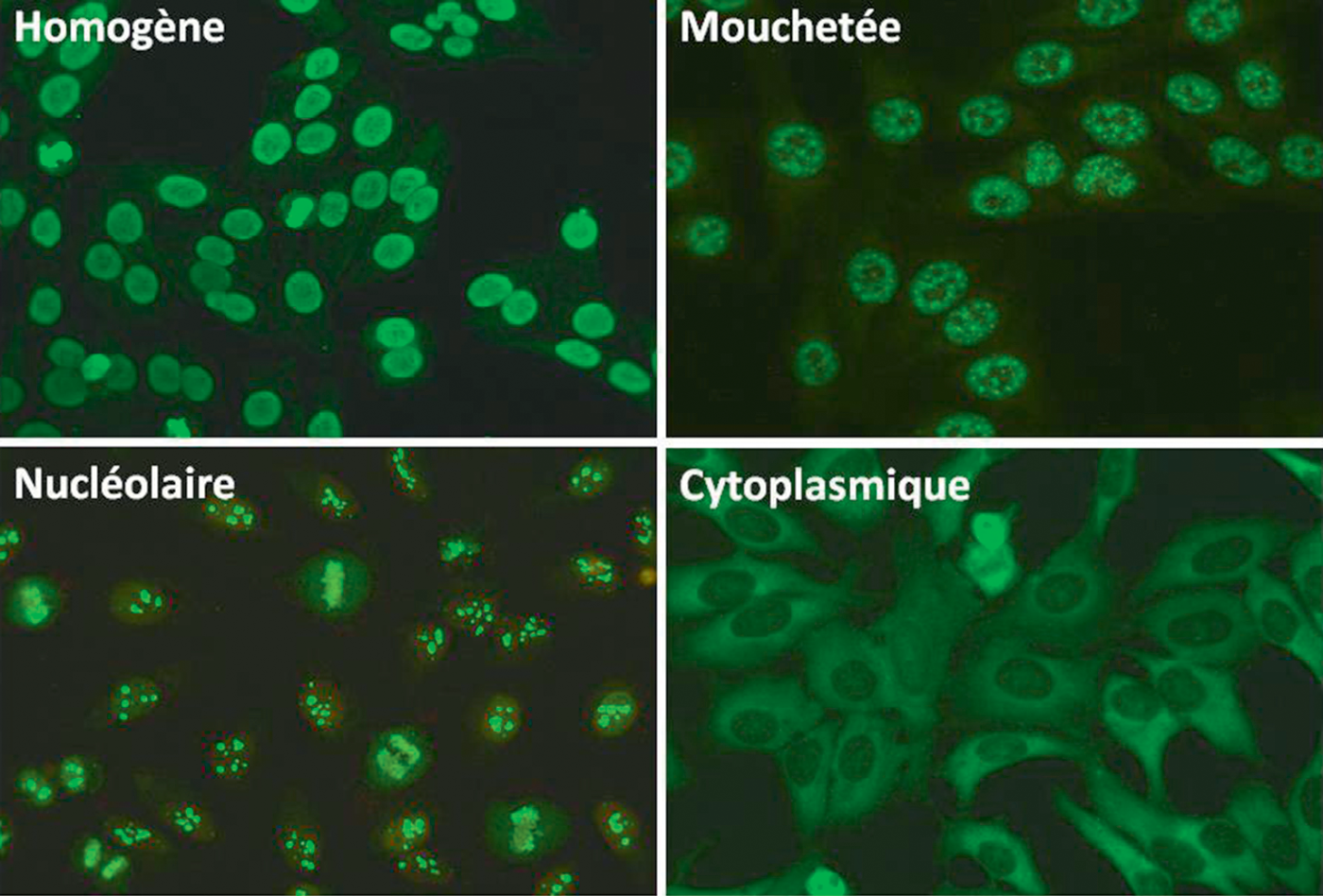
Tableau 13.7. ![]() Recherche d’anticorps antinucléaires.
Recherche d’anticorps antinucléaires.
|
Étapes |
Technique |
Intérêt |
| Dépistage |
Immunofluorescence indirecte sur cellules HEp2 |
Titre (inverse de la plus grande dilution permettant d’observer la fluorescence) considéré comme significatif si > 1/80e ou ≥ 1/160e |
|
Aspect de la fluorescence (par exemple : homogène, mouchetée, centromérique, nucléolaire) (Ces aspects ne sont pas mutuellement exclusifs et peuvent se superposer) |
||
| Caractérisation des anticorps détectés |
Nombreuses techniques possibles (ELISA, Luminex®, immunodots, Bio-Plex®) |
Selon l’aspect de la fluorescence : – homogène : recherche d’anticorps anti-ADN double brin (ou anti-ADN natif) (très spécifiques du lupus systémique), d’anticorps anti-histones et anti-nucléosome – mouchetée : recherche d’anticorps anti-ENA (Extractable Nuclear Antigens), qui regroupent principalement les anticorps anti-Sm, anti-RNP, anti-SSA (Ro), anti-SSB (La), anti-PM/Scl, anti-JO1 et anti-Scl70 – autres aspects possibles : centromérique, nucléolaire, etc. (avec des cibles spécifiques) |
Rappelons que des anticorps antinucléaires (en particulier à faible titre) sont rencontrés chez environ 10 % des sujets sains (en particulier chez les sujets âgés, mais aussi chez la femme), lors de stimulation du système immunitaire (infections profondes, bactériennes ou virales) au cours des hépatites auto-immunes (80–100 %), de la polyarthrite rhumatoïde (10–20 %), mais également de nombreuses maladies auto-immunes spécifiques d’organes (myasthénie, sclérose en plaques, etc.). La spécificité d’une recherche positive d’anticorps antinucléaires est donc faible et il est indispensable de caractériser les anticorps pour en identifier la cible.
Les anticorps anti-ADN natif sont beaucoup plus spécifiques du lupus systémique. Outre leur intérêt diagnostique, ils sont intéressants pour la surveillance car leur taux fluctue avec l’activité de la maladie. Leur augmentation doit faire craindre une poussée, notamment hématologique ou rénale.
Il n’existe en revanche pas de corrélation entre le taux d’anticorps anti-antigènes nucléaires solubles (fig. 13.2) et l’activité de la maladie. Ces anticorps ne sont donc recherchés qu’au diagnostic.
Fig. 13.2. ![]() Recherche de la spécificité des anticorps antinucléaires et orientation diagnostique.
Recherche de la spécificité des anticorps antinucléaires et orientation diagnostique.
Dans plusieurs études, une corrélation entre la consommation de la fraction C3 et C4 du complément et l’activité du lupus systémique a été retrouvée. Cette consommation de la fraction C3 et C4 pourrait aussi être associée à une pathologie plus sévère. Ce dosage est donc utile à la surveillance de la maladie lupique.
Les anticorps antiphospholipides (aPL) représentent une famille hétérogène d’autoanticorps dirigés contre les phospholipides des membranes (par exemple, anticorps anti-cardiolipines, aCL) ou contre leurs cofacteurs protéiques (β2-glycoprotéine 1, anti-β2GP1) (tableau 13.8).
La présence d’un anticorps antiphospholipides doit être confirmée par un nouveau dosage au moins 12 semaines plus tard.
Tableau 13.8. ![]() Principaux anticorps antiphospholipides.
Principaux anticorps antiphospholipides.
|
Marqueur du SAPL |
Technique de recherche |
|
Anticorps anti-cardiolipine (aCL) |
ELISA (principalement) |
|
Anticorps anti-β2-glycoprotéine 1 (anti-β2GP1) |
ELISA (principalement) |
|
Anticoagulant circulant (ACC) |
Test d’hémostase (temps de venin de vipère Russell dilué [dRVVT]) |
Le facteur rhumatoïde (FR) est une immunoglobuline, le plus souvent de type IgM, ayant une activité anticorps dirigée contre les immunoglobulines G.
La sensibilité et la spécificité d’une recherche positive de FR dépendent beaucoup du contexte clinique : la sensibilité est d’environ 60 à 80 %.
Rappelons que la présence de FR n’est pas spécifique de la polyarthrite rhumatoïde (spécificité de 65 à 85 %) et qu’il peut se rencontrer au cours de certaines maladies infectieuses (endocardite, VHC, leishmaniose), d’autres maladies auto-immunes (20 à 30 % des patients lupiques, 50 à 80 % au cours du syndrome de Sjögren), des hépatopathies, de certaines hémopathies lymphoïdes, ainsi que chez les sujets sains, en particulier âgés (jusqu’à 6–10 % de positivité).
Les anticorps anti-peptides cycliques citrullinés (anti-CCP) ou, plus récemment, les ACPA (Anti-Citrullinated Protein Antibodies) sont positifs dans 60 à 75 % des PR récentes, avec une spécificité élevée (de l’ordre de 90 à 95 %). Les anti-CCP sont positifs dans 30 % des PR négatives pour le FR.
Par ailleurs, la positivité conjointe des FR et des anti-CCP confère une très bonne valeur prédictive positive pour le diagnostic de PR (98–100 %), avec toutefois une sensibilité n’excédant pas 40–50 %.
Enfin, les anticorps anti-CPP et les ACPA ont une valeur pronostique car ils sont statistiquement associés aux formes érosives. En revanche, il n’existe pas de corrélation entre leur taux et l’activité de la maladie. Ces autoanticorps ne sont donc recherchés qu’au diagnostic.
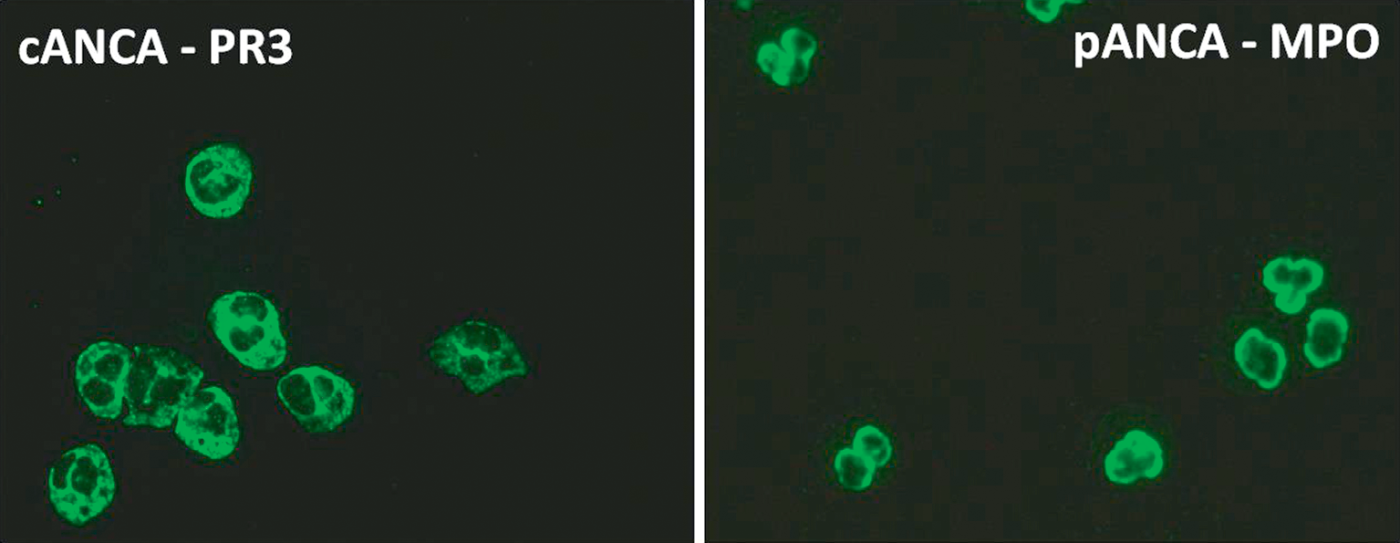
Les ANCA sont des autoanticorps dirigés contre des antigènes présents dans les granules des polynucléaires neutrophiles. Ce sont des marqueurs diagnostiques très importants de certaines vascularites des vaisseaux de petit calibre, dont ils ont profondément modifié la stratégie diagnostique et la classification.
Leur dépistage s’effectue par immunofluorescence indirecte (IFI) sur des frottis de polynucléaires humains fixés à l’éthanol, ce qui permet de définir trois types d’anticorps en fonction de la localisation (tableau 13.9).
Tableau 13.9. ![]() ANCA et maladies associées.
ANCA et maladies associées.
|
Aspect de la fluorescence |
Principale cible antigénique |
Pathologies associées |
|
c-ANCA (cytoplasmique) |
Protéinase-3 |
– Granulomatose avec polyangéite |
|
p-ANCA (périnucléaire) |
Myéloperoxydase |
– Granulomatose éosinophilique avec polyangéite – Polyangéite microscopique |
|
x-ANCA (aspect atypique de la fluorescence) |
Autres cibles |
– Rectocolite hémorragique – Maladie de Crohn – Cholangite sclérosante primitive |
En présence d’un aspect évocateur (fig. 13.3), l’identification de la cible antigénique s’effectue le plus souvent par ELISA ou par des techniques de bandelettes réactives (également nommées « dot blots »).
La sensibilité de la recherche d’ANCA étant limitée, il est important de souligner qu’une recherche d’ANCA négative ne permet pas d’exclure une vascularite à ANCA.
La réapparition d’ANCA ou l’augmentation de leur taux doit faire craindre une poussée. Le dosage est donc utile au suivi des patients.
Fig. 13.3. ![]() Aspect typique des c-ANCA et p-ANCA.
Aspect typique des c-ANCA et p-ANCA.
Avec les progrès thérapeutiques et l’allongement de l’espérance de vie, la prise en charge thérapeutique ne se réduit plus au simple contrôle de l’activité de la maladie et à la prévention des poussées. Le traitement des maladies auto-immunes comporte de nombreux objectifs (encadré 13.1) et repose le plus souvent sur un « traitement d’attaque » suivi par un « traitement d’entretien ou traitement de fond » :
Encadré 13.1. Principaux objectifs thérapeutiques au cours des maladies auto-immunes
Le traitement des maladies auto-immunes passe aussi par le contrôle des facteurs de risque cardiovasculaire. En effet, le risque cardiovasculaire est globalement accru au cours des maladies auto-immunes. Il est ainsi recommandé d’évaluer les facteurs de risque cardiovasculaire et de proposer, si nécessaire, une prise en charge adaptée (règles hygiéno-diététiques, traitement pharmacologique d’une hypertension artérielle, d’un diabète ou d’une dyslipidémie, arrêt du tabac, etc.).
Enfin, la prévention des infections passe par une utilisation raisonnée de la corticothérapie et des traitements immunosuppresseurs, et par la vaccination (notamment contre la grippe saisonnière et le pneumocoque). Rappelons ici que les vaccins vivants sont contre-indiqués chez les patients sous corticothérapie > 10 mg et/ou immunosuppresseurs.
Les grossesses ne sont pas contre-indiquées mais devront être discutées selon la maladie, son activité et les traitements.
![]() Le recours à un traitement symptomatique, notamment à l’aide de médicaments antalgiques ou anti-inflammatoires (en gardant en tête les nombreuses contre-indications de ces traitements), peut être nécessaire au cours des poussées des maladies auto-immunes.
Le recours à un traitement symptomatique, notamment à l’aide de médicaments antalgiques ou anti-inflammatoires (en gardant en tête les nombreuses contre-indications de ces traitements), peut être nécessaire au cours des poussées des maladies auto-immunes.
![]() Les corticoïdes demeurent un des piliers du traitement initial des maladies auto-immunes et sont souvent nécessaires au cours des poussées pour contrôler l’activité de la maladie, en particulier lors des poussées sévères.
Les corticoïdes demeurent un des piliers du traitement initial des maladies auto-immunes et sont souvent nécessaires au cours des poussées pour contrôler l’activité de la maladie, en particulier lors des poussées sévères.
L’intérêt principal des corticoïdes vient de leur efficacité rapide permettant de contrôler le tableau inflammatoire et d’éviter des complications définitives, notamment en cas d’atteintes viscérales. En revanche, leur toxicité à moyen et long terme (et même certaines complications immédiates) est désormais bien reconnue (risque cardiovasculaire, risque infectieux, risque osseux…). Aussi, il n’est pas recommandé d’utiliser des corticoïdes si le patient n’a aucun risque de développer des séquelles de sa pathologie. Si des corticoïdes sont introduits, une stratégie de décroissance, puis d’arrêt, doit être envisagée dès le départ. Enfin, avant d’introduire une corticothérapie, il convient de documenter la poussée afin de proposer un suivi adapté.
La sclérodermie systémique représente une situation au cours de laquelle l’indication de la corticothérapie doit être prudente, car l’utilisation de posologies supérieures à 10 mg par jour a été associée à un risque accru de survenue de crise rénale sclérodermique.
De nombreux agents immunomodulateurs, immunosuppresseurs ou biothérapies peuvent être utilisés au cours du traitement des maladies auto-immunes pour contrôler l’activité de la maladie, permettant ainsi, si nécessaire, l’épargne cortisonique. Dans les maladies systémiques, le choix du traitement immunomodulateurs ou immunosuppresseurs dépend des manifestations, notamment de certaines atteintes d’organes. Dans les atteintes les plus sévères, le traitement est souvent plus intense lors d’une phase d’induction, puis suivi d’une phase d’entretien sur quelques mois ou années.
Dans certaines maladies spécifiques d’organe, le traitement est seulement substitutif (insuline si diabète de type 1, hormones thyroïdiennes si hypothyroïdie…), sans utilisation d’immunosuppresseur.
De nombreux traitements (à l’exception notable de l’hydroxychloroquine et de l’azathioprine) sont tératogènes, et une contraception est donc nécessaire.
Le risque d’infection (et plus rarement de cytopénie) justifie une surveillance clinique et biologique régulière et une information spécifique du patient sur la nécessité de consulter rapidement en cas de fièvre.
De nombreuses mesures associées peuvent permettre d’améliorer la prise en charge globale des patients atteints de maladie auto-immune (tableau 13.10). Les autres mesures associées peuvent comporter la prescription d’un arrêt de travail et, plus généralement, la prévention de l’ostéoporose cortico-induite. S’il le souhaite, le patient peut également être orienté vers une association de malades.
Il est aussi recommandé de proposer aux patients des séances d’éducation thérapeutiques qui permettront une meilleure acceptation de la maladie, une prévention et une reconnaissance des poussées, la prise en charge des comorbidités, l’adhésion thérapeutique et la prévention des complications des traitements.
Tableau 13.10. ![]() Principales mesures associées à la prise en charge des patients atteints de maladies auto-immunes.
Principales mesures associées à la prise en charge des patients atteints de maladies auto-immunes.
|
Mesures associées |
Objectifs |
|
Éducation thérapeutique |
Démarche multidisciplinaire permettant une meilleure compréhension de la maladie par le patient Permet l’adhésion à la démarche thérapeutique sur le long terme (favorise l’observance) |
|
Mesures sociales |
Prise en charge à 100 % (ALD) AME pour les patients en situation de précarité Reconnaissance de la qualité de travailleur handicapé (RQTH) |
|
Kinésithérapie et rééducation |
Renforcement musculaire, travail des amplitudes articulaires, lutte contre les rétractions, etc. |
|
Podologie |
Confection de semelles (pieds rhumatoïdes, sclérodermie systémique) |
|
Ergothérapie |
Confection d’orthèse (prévention des déformations), aides techniques Adaptation du poste de travail (maintien de l’insertion socioprofessionnelle) |
|
Orthophonie |
Lutte contre les séquelles des atteintes neurologiques centrales |
|
Prise en charge diététique |
En particulier lors de l’utilisation d’une corticothérapie au long cours |
|
Soutien psychologique |
Phase d’annonce de la maladie inflammatoire ou au cours de l’évolution si nécessaire |
|
Thérapies complémentaires* |
Hypnose médicale, sophrologie, yoga, etc. |
|
* Par des professionnels de santé. |
|
La majorité des maladies auto-immunes sont des pathologies chroniques. Elles évoluent par poussées, entrecoupées de périodes de rémission. Cependant, dans certains cas, la maladie peut rester quiescente de manière prolongée ou, au contraire, être active de manière continue et évoluer rapidement vers des atteintes viscérales graves. La prise en charge des patients atteints de maladies auto-immunes repose donc sur un suivi médical régulier (tableau 13.11).
Tableau 13.11. ![]() Principaux éléments du suivi au cours des maladies auto-immunes.
Principaux éléments du suivi au cours des maladies auto-immunes.
|
Paramètres du suivi |
Modalités |
|
Activité de la maladie : manifestations réversibles |
– Examen clinique – Examens paracliniques (par exemple, biologiques, radiologiques) – Scores dédiés (par exemple, DAS28 au cours de la PR) |
|
Séquelles : manifestations irréversibles liées à la maladie et/ou à ses traitements |
|
|
Qualité de vie |
– Interrogatoire et scores dédiés (par exemple, SF36) |
|
Statut fonctionnel |
– Interrogatoire, examen clinique et scores dédiés (par exemple, Health Assessment Questionnaire, HAQ) |
|
Tolérance des traitements |
– Interrogatoire et examens clinique et biologiques |
|
Observance des traitements |
– Interrogatoire et dosages de certains médicaments |
Le suivi des patients est effectué par le médecin généraliste, le rhumatologue et les éventuels autres spécialistes d’organe. Par ailleurs, il faut surveiller la tolérance de chaque traitement et l’apparition d’éventuels effets indésirables ou complications (diabète ou ostéoporose cortico-induits, rétinopathie aux antipaludéens de synthèse et cataracte cortisonique…).
Légende :
Dans le respect de la Réforme du deuxième cycle des études médicales (R2C), les connaissances rassemblées sur ce site sont hiérarchisées en rang A, rang B et rang C à l'aide de balises et d'un code couleur :
![]() Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
![]() Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
![]() Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).
