Ostéopathies fragilisantes
![]() La définition de l’ostéoporose de l’OMS est la suivante : « L’ostéoporose est une maladie généralisée du squelette, caractérisée par une résistance osseuse diminuée prédisposant à un risque élevé de fracture. La résistance osseuse est la résultante de la densité osseuse et de la qualité osseuse (altération de la microarchitecture osseuse notamment). »
La définition de l’ostéoporose de l’OMS est la suivante : « L’ostéoporose est une maladie généralisée du squelette, caractérisée par une résistance osseuse diminuée prédisposant à un risque élevé de fracture. La résistance osseuse est la résultante de la densité osseuse et de la qualité osseuse (altération de la microarchitecture osseuse notamment). »
Un épisode fracturaire est la complication de la maladie ostéoporotique et constitue toute la gravité de cette maladie. En pratique, toute fracture survenant après un traumatisme à bas niveau d’énergie (comme une chute de sa hauteur) et après l’âge de 50 ans doit faire évoquer une ostéoporose (sauf en cas de fracture du crâne, de la face, du rachis cervical, des trois premières vertèbres thoraciques, des doigts et des orteils).
Certaines fractures sont dites sévères car associées à un excès de mortalité, c’est le cas de la fracture :
C’est à la suite de la FESF que l’excès précoce de mortalité est le plus important, surtout chez les hommes : 1 femme sur 6 et 1 homme sur 4 vont décéder dans l’année qui suit une FESF, ce qui traduit la gravité de cette fracture et la nécessité de l’éviter.
D’autres fractures dites « non sévères » (os de l’avant-bras) ne sont pas associées à un excès de mortalité.
On parle également de fractures majeures pour les quatre sites ayant la plus grande incidence (représentant environ 80 % des fractures ostéoporotiques) : FESF, FESH, poignet et fracture vertébrale clinique (clinique signifie révélée par un syndrome rachidien douloureux ; 2/3 des fractures vertébrales sont découvertes « fortuitement » et non dans les suites d’une douleur aiguë du rachis).
![]() Après 50 ans, 1 femme sur 2 et 1 homme sur 5 auront une fracture ostéoporotique au cours de leur vie, ce qui témoigne de la fréquence de cette maladie.
Après 50 ans, 1 femme sur 2 et 1 homme sur 5 auront une fracture ostéoporotique au cours de leur vie, ce qui témoigne de la fréquence de cette maladie.
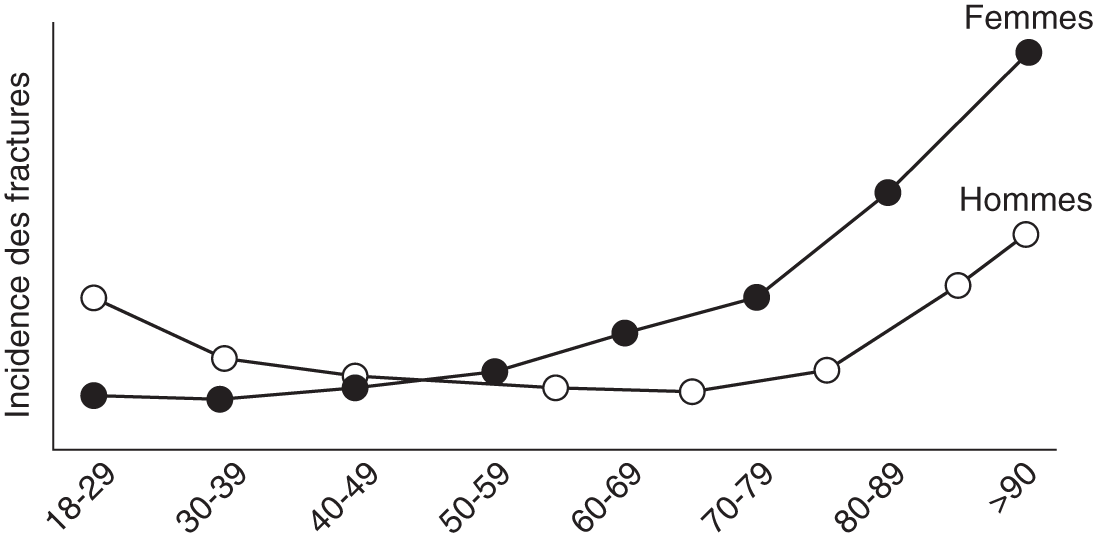
L’incidence des fractures ostéoporotiques augmente de façon exponentielle à partir de 50 ans chez les femmes et 70 ans chez les hommes. Avant 50 ans, l’incidence des frac-tures est plus importante chez les hommes car davantage d’origine traumatique (fig. 7.1).
En France, en 2019, on estime le nombre de nouvelles fractures par fragilité osseuse à 480 000 ; ce nombre va augmenter avec le vieillissement de la population avec un nombre estimé à 610 000 en 2034.
Fig. 7.1. ![]() Courbes des incidences de fractures chez l’adulte par sexe et classe d’âge.
Courbes des incidences de fractures chez l’adulte par sexe et classe d’âge.
Le squelette est composé d’os cortical (majoritaire dans la diaphyse des os longs) et d’os trabéculaire (majoritaire dans les vertèbres).
Le tissu osseux a plusieurs fonctions :
Il existe un remaniement constant de ce tissu appelé remodelage osseux. Le remodelage osseux comporte schématiquement :
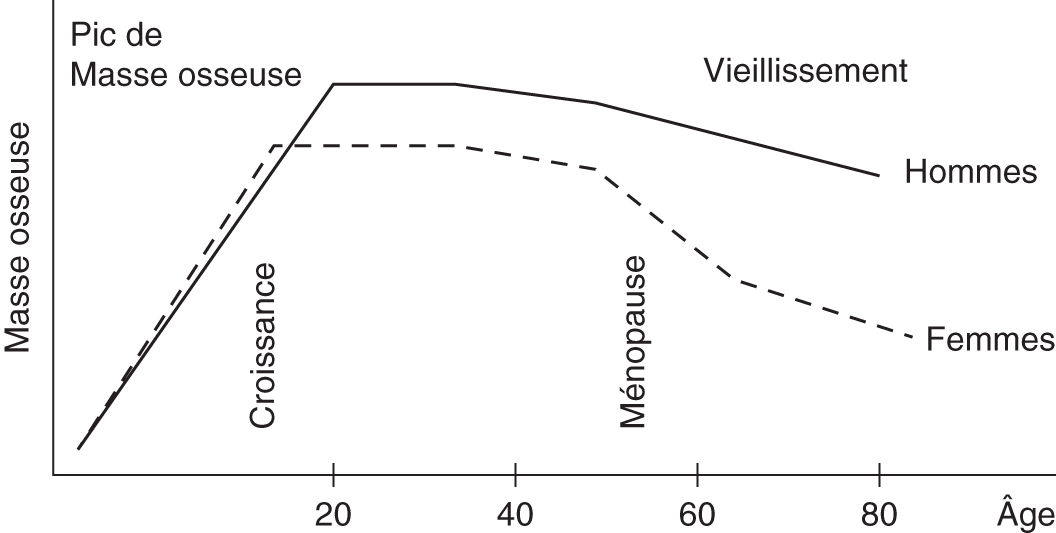
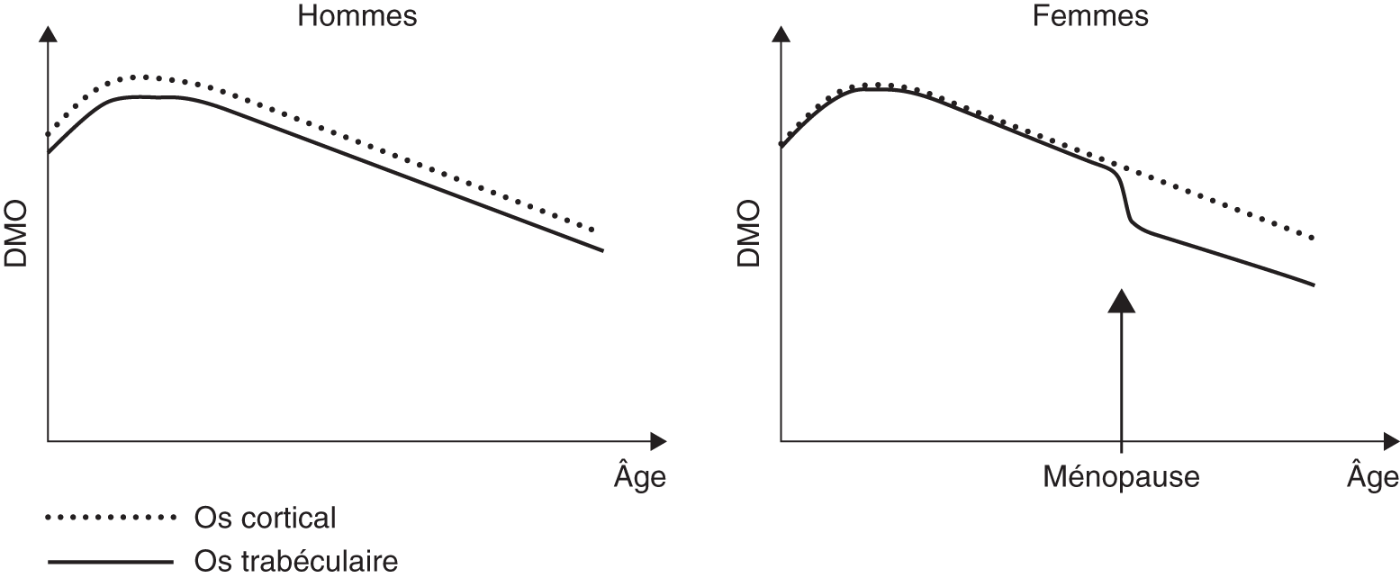
Fig. 7.2. ![]() Évolution de la masse osseuse.
Évolution de la masse osseuse.
![]() L’ostéoporose est une maladie silencieuse jusqu’à l’événement fracturaire.
L’ostéoporose est une maladie silencieuse jusqu’à l’événement fracturaire.
La définition conceptuelle de l’ostéoporose est une maladie généralisée du squelette, caractérisée par une résistance osseuse diminuée prédisposant à un risque élevé de fracture. La résistance osseuse est la résultante de la densité osseuse et de la qualité osseuse (altération de la microarchitecture osseuse notamment.)
La qualité osseuse ne pouvant pas être mesurée cliniquement, une autre définition de l’ostéoporose plus opérationnelle fondée sur la densité osseuse est également utilisée (T-score de DMO ≤ – 2,5). Cependant cette définition a des limites car la moitié des fractures ostéoporotiques surviennent chez des patients ayant des T-scores de DMO > – 2,5 et tous les patients ayant des T-scores de DMO < – 2,5 n’auront pas des fractures ostéoporotiques. Ainsi, la DMO est à considérer avant tout comme un facteur de risque important de fracture ostéoporotique.
Le diagnostic d’ostéoporose doit être évoqué :
La survenue de fractures fait toute la gravité de la maladie ostéoporotique.
On distingue classiquement trois groupes de fractures :
Les fractures ostéoporotiques sont classées dans le groupe des fractures par insuffisance osseuse.
Toute fracture survenant en dehors d’un traumatisme violent, c’est-à-dire pour une énergie correspondant à une simple chute de sa hauteur, doit faire évoquer le diagnostic d’ostéoporose (sauf les fractures du crâne, du rachis cervical, des trois premières ver-tèbres thoraciques, des doigts et des orteils).
Les plus fréquentes des fractures ostéoporotiques sont la fracture du poignet survenant souvent précocement dès 50 ans, la fracture vertébrale et la FESF survenant le plus souvent après 70 ans. Ainsi, la fracture du poignet doit être considérée comme un signal d’alarme conduisant à la recherche de facteurs de risque d’ostéoporose et à la réalisation d’une DMO. Attention, toutes les fractures du poignet ne sont pas ostéoporotiques !
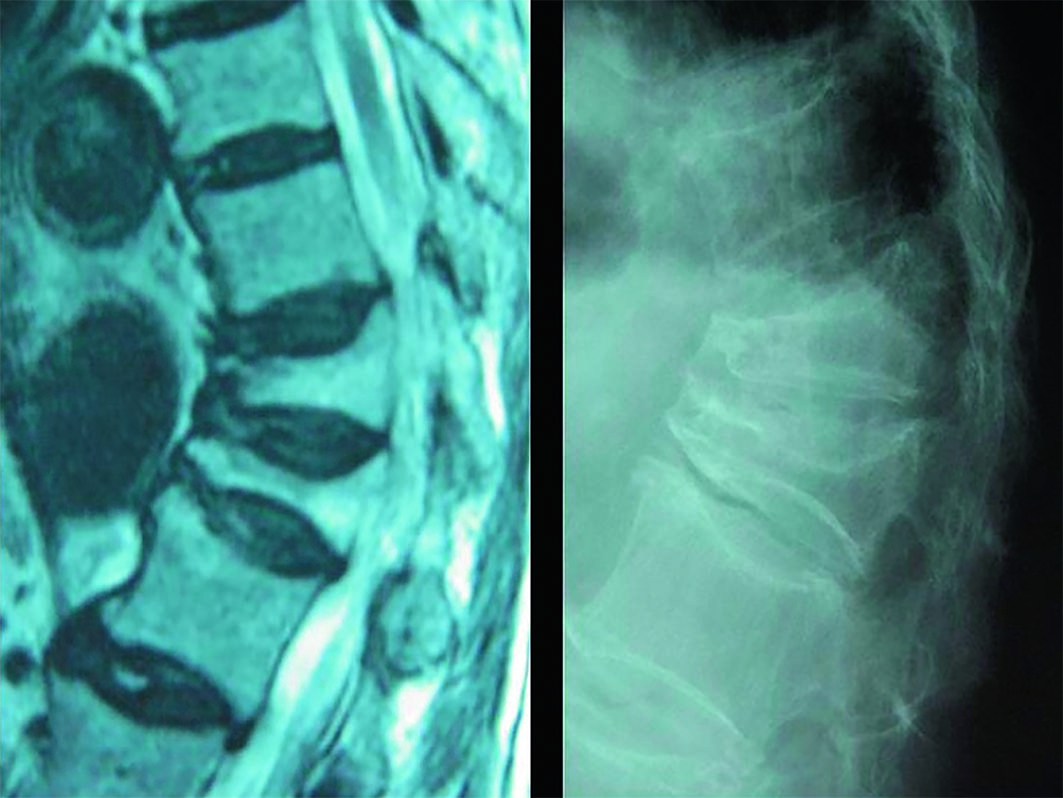
La fracture vertébraleostéoporotique (fig. 7.3) n’est pas toujours symptomatique. Lors-qu’elle l’est, elle se traduit par des rachialgies aiguës d’horaire mécanique et une impo-tence fonctionnelle souvent sévère. La douleur s’estompe habituellement en 4 à 6 semaines. L’état général du patient est conservé et l’examen neurologique est normal (respect du mur postérieur). Environ deux tiers des fractures vertébrales ne sont pas recon-nues lors de l’épisode fracturaire et sont découvertes fortuitement sur des imageries ulté-rieures. Les fractures vertébrales modifient les courbures rachidiennes et sont responsables d’une perte de taille. Ainsi, il est recommandé de pratiquer des radiographies du rachis dorsolombaire à la recherche de fracture(s) vertébrale(s) en cas de perte de taille significative (≥ 4 cm par rapport à une taille déclarée). Il est donc fondamental de mesurer les patients.
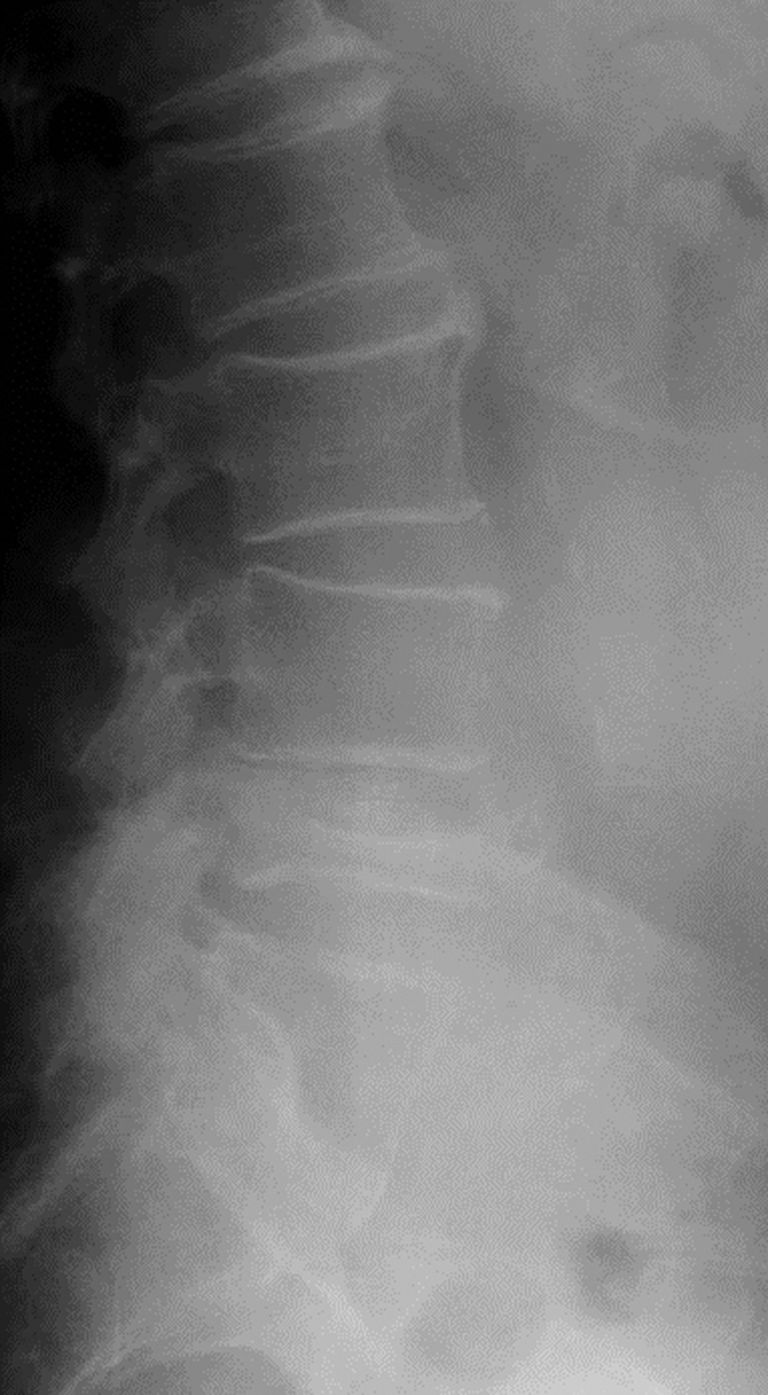
Fig. 7-3 :![]() Radiographie du rachis lombaire de profil. Fracture vertébrale de L4 en « galette ».
Radiographie du rachis lombaire de profil. Fracture vertébrale de L4 en « galette ».
La fracture de l’extrémité supérieure du fémur est la fracture à la suite de laquelle l’excès de mortalité est le plus important : 20 % des hommes et 15 % des femmes décèdent dans l’année qui suit l’hospitalisation pour fracture de hanche.
Ces fractures emblématiques ne doivent pas faire oublier les autres fractures périphériques qui peuvent également révéler une fragilité osseuse et qui sont trop souvent négligées : humérus, côtes, bassin, tibia…
L’ostéoporose correspond à une fragilité osseuse et les études biomécaniques montrent que la densité minérale osseuse (DMO) est le déterminant principal de la fragilité osseuse.
L’absorptiométrie biphotonique aux rayons X (DXA) est la technique de référence pour la mesure de la DMO.
La DXA mesure la densité surfacique du tissu minéralisé (et ne permet donc pas de pré-juger de la cause d’une densité basse).
Les caractéristiques de la DXA (fig. 7.4) sont :
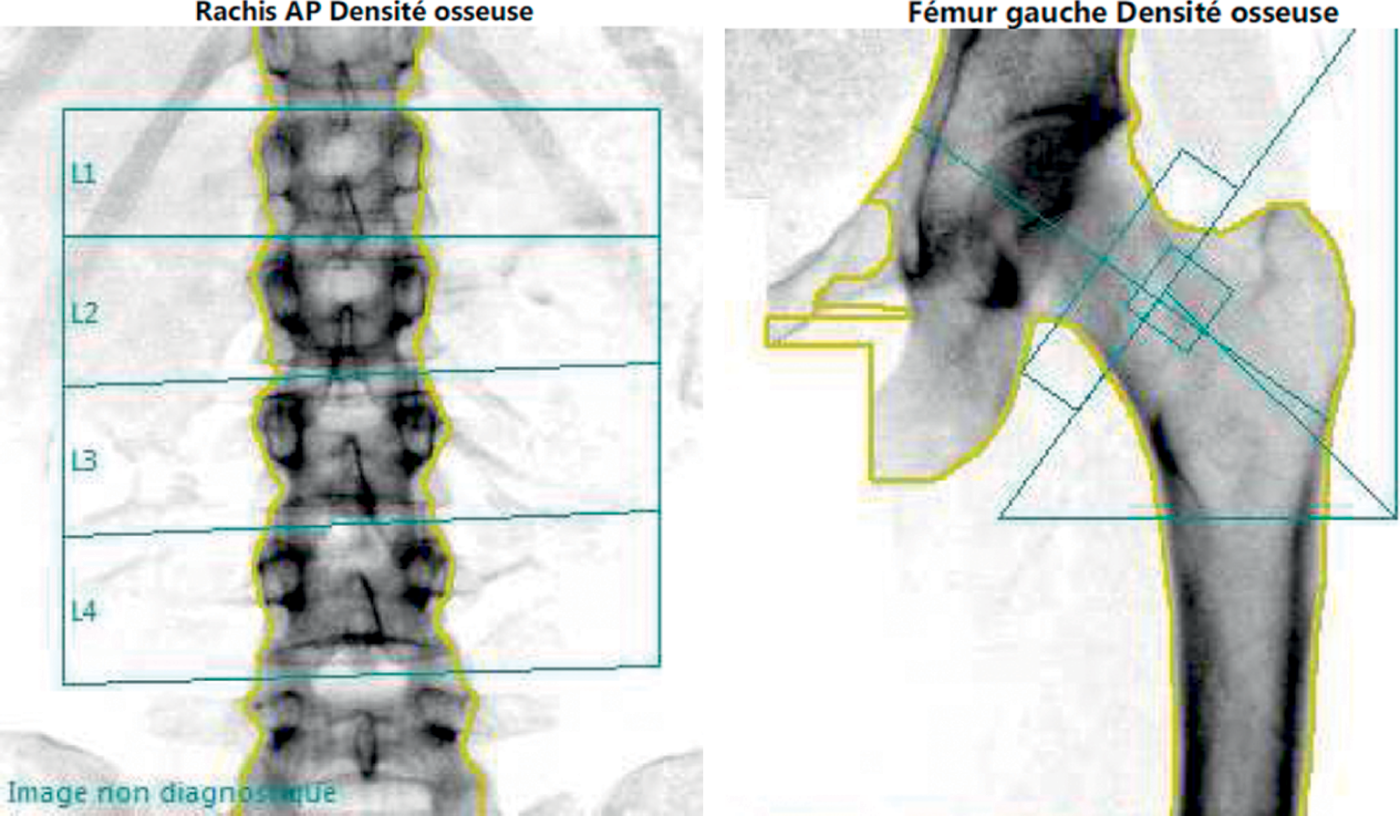
Fig. 7-4 :![]() Mesure de la densité minérale osseuse : images de DXA (rachis lombaire et extrémité supérieure du fémur).
Mesure de la densité minérale osseuse : images de DXA (rachis lombaire et extrémité supérieure du fémur).
La DXA permet la mesure de la DMO en plusieurs sites squelettiques dont le contenu respectif en os cortical et en os trabéculaire est différent. Le rachis lombaire, riche en os trabéculaire, est le plus sensible en postménopause, tandis que l’extrémité supérieure du fémur (ESF), plus riche en cortical, sera surtout analysée après 65 ou 70 ans.
Il faut se méfier des mesures de DMO artificiellement augmentées par des lésions arthro-siques ou des fractures vertébrales.
Concernant les résultats de la DXA :
Lors de la survenue d’une fracture d’allure ostéoporotique (ou sa découverte sur des ra-diographies) ou devant la découverte par l’interrogatoire d’un ou plusieurs facteurs de risque d’ostéoporose, la réalisation d’une DMO est nécessaire (encadré 7.1).
Surtout, la mesure de la DMO peut permettre de faire le diagnostic d’ostéoporose avant la survenue d’une fracture en présence de facteurs de risque d’ostéoporose.
Encadré 7.1 : Indications d'ostéodensitométrie reconnues et remboursées par l'assurance maladie (à titre indicatif)
Surtout, la mesure de la DMO peut permettre de faire le diagnostic d'ostéoporose avant la survenue d'une fracture en présence de facteurs de risque d'ostéoporose.
Évolution de la DMO au cours de la vie
La figure 7.5 montre l’évolution de la DMO lombaire au cours de la vie chez la femme et chez l’homme (cf. section III.A).
Fig. 7-5 :![]() Évolution de la densité minérale osseuse chez l'homme et la femme en fonction de l'âge.
Évolution de la densité minérale osseuse chez l'homme et la femme en fonction de l'âge.
Pour le clinicien, un certain nombre de facteurs de risque essentiels pour l’évaluation du risque fracturaire doivent être pris en compte :
De nombreux autres facteurs de risque de baisse de DMO ou de fractures existent. En pratique, la décision thérapeutique est guidée par une évaluation du risque individuel de fracture ostéoporotique tenant compte de l’ensemble de ces facteurs de risque.
Facteurs de risque non modifiables
Facteurs de risque modifiables = secondaires
* La recherche de ces causes d’ostéoporose secondaire chez les hommes chez qui elles sont prédominantes mais également chez les femmes est fondamentale pour comprendre la fragilité osseuse et la prendre correctement en charge.
La corticothérapie, quel qu’en soit le motif, est à l’origine d’une perte osseuse dont l’intensité dépend de la dose reçue et de la durée du traitement, pouvant conduire à la survenue de fractures avec un niveau de DMO plus élevé que dans l’ostéoporose post-ménopausique.![]() Certaines de ces causes d’ostéoporose secondaire sont incluses dans le score FRAX®.Ce score est un outil proposé par l’OMS qui permet de quantifier (en %), en combinant des facteurs de risque d’ostéoporose associés ou pas avec la DMO au col fémoral, le risque de fractures majeures (FESF, humérus, poignets et fractures vertébrales cliniques) et de FESF dans les 10 ans et qui a été validé chez les femmes ménopausées et chez les hommes de plus de 40 ans. Le calcul du FRAX® n’est pas utile chez les patients dont l’indication de traiter est évidente comme par exemple les patients avec antécédents de fracture, mais il peut être utile en l’absence de fracture. Le calcul du FRAX® peut être réalisé directement à partir du site internet du FRAX® .
Certaines de ces causes d’ostéoporose secondaire sont incluses dans le score FRAX®.Ce score est un outil proposé par l’OMS qui permet de quantifier (en %), en combinant des facteurs de risque d’ostéoporose associés ou pas avec la DMO au col fémoral, le risque de fractures majeures (FESF, humérus, poignets et fractures vertébrales cliniques) et de FESF dans les 10 ans et qui a été validé chez les femmes ménopausées et chez les hommes de plus de 40 ans. Le calcul du FRAX® n’est pas utile chez les patients dont l’indication de traiter est évidente comme par exemple les patients avec antécédents de fracture, mais il peut être utile en l’absence de fracture. Le calcul du FRAX® peut être réalisé directement à partir du site internet du FRAX® .
![]() Elles sont essentielles. Elles ont pour objectif d’affirmer la nature ostéoporotique de la fracture, de mettre éventuellement en évidence une cause d’ostéoporose secondaire et surtout d’éliminer les autres causes de fragilité osseuse dont la prise en charge est différente (cf. section IV.E).
Elles sont essentielles. Elles ont pour objectif d’affirmer la nature ostéoporotique de la fracture, de mettre éventuellement en évidence une cause d’ostéoporose secondaire et surtout d’éliminer les autres causes de fragilité osseuse dont la prise en charge est différente (cf. section IV.E).
![]() Les radiographies standards de la fracture montrent l’existence d’une déminéralisation homogène sans signe d’ostéolyse.
Les radiographies standards de la fracture montrent l’existence d’une déminéralisation homogène sans signe d’ostéolyse.
En pratique, l’évaluation morphologique du rachis (par des radiographies le plus souvent) est indiquée s’il existe des rachialgies et/ou une perte de taille ≥ 4 cm. Il faut savoir « traquer » la fracture vertébrale au cours du bilan de l’ostéoporose. Les radiographies comprennent le rachis lombaire et dorsal (même si la douleur paraît lombaire, il est important de réaliser un cliché dorsal pour ne pas méconnaître une fracture vertébrale dorsale avec projection douloureuse lombaire ou une autre fracture vertébrale non symptomatique).
Au rachis, plusieurs arguments plaident en faveur de la nature ostéoporotique d’une fracture vertébrale :
Cependant, aucun de ces signes n’est totalement spécifique. En cas de doute, la réalisa-tion d’un scanner et/ou d’une IRM (fig. 7.6) permettra de confirmer l’absence de signes évocateurs d’une autre origine, en particulier tumorale.
Fig. 7.6. ![]() Fractures vertébrales d’allure ostéoporotique.
Fractures vertébrales d’allure ostéoporotique.
![]() Il n’y a pas de consensus sur les examens initiaux à effectuer systématiquement. On peut proposer de doser initialement :
Il n’y a pas de consensus sur les examens initiaux à effectuer systématiquement. On peut proposer de doser initialement :
Ces dosages ont pour but d’éliminer un diagnostic différentiel : une ostéopathie maligne (myélome ou métastases) ou une fragilité osseuse bénigne non ostéoporotique.
Au cours de l’ostéoporose, ces examens sont le plus souvent normaux. En effet, la cal-cémieet la phosphatémiesont normales dans l’ostéoporose.![]() À l'issue de ce bilan, il est exceptionnellement nécessaire de recourir à la biopsie osseuse avec double marquage à la tétracycline. Celle-ci reste indiquée dans des cas rares chez des gens jeunes par exemple en cas d'ostéoporose fracturaire avec une DMO peu abaissée, en l'absence de cause retrouvée, lors d'altérations complexes du métabolisme osseux chez des insuffisants rénaux.
À l'issue de ce bilan, il est exceptionnellement nécessaire de recourir à la biopsie osseuse avec double marquage à la tétracycline. Celle-ci reste indiquée dans des cas rares chez des gens jeunes par exemple en cas d'ostéoporose fracturaire avec une DMO peu abaissée, en l'absence de cause retrouvée, lors d'altérations complexes du métabolisme osseux chez des insuffisants rénaux.
![]() Devant une fracture d'allure ostéoporotique ou lors de la découverte d'une ostéoporose densitométrique, le diagnostic d'ostéoporose ne peut être retenu qu'après avoir éliminé :
Devant une fracture d'allure ostéoporotique ou lors de la découverte d'une ostéoporose densitométrique, le diagnostic d'ostéoporose ne peut être retenu qu'après avoir éliminé :
Ces dosages ont pour but d’éliminer un diagnostic différentiel : une ostéopathie maligne (myélome ou métastases) ou une fragilité osseuse bénigne non ostéoporotique.
Au cours de l’ostéoporose, ces examens sont le plus souvent normaux. En effet, la cal-cémieet la phosphatémiesont normales dans l’ostéoporose.
![]() Dans un deuxième temps, en fonction des données de l'examen clinique et des premiers résultats, des dosages biologiques permettent d'identifier une cause secondaire d'ostéoporose :
Dans un deuxième temps, en fonction des données de l'examen clinique et des premiers résultats, des dosages biologiques permettent d'identifier une cause secondaire d'ostéoporose :
Quel que soit l’âge du patient et quel que soit l’objectif poursuivi (prévention de l’ostéoporose ou traitement d’une ostéoporose avérée), les mesures hygiéno-diététiques suivantes doivent toujours être mises en œuvre :
![]() Les traitements anti-ostéoporotiques freinent la résorption osseuse ou stimulent la for-mation osseuse. Ils diminuent le risque de fracture vertébrale d’environ 40 à 70 % (en fonction des médicaments et de la gravité de l’ostéoporose) et le risque de fracture péri-phérique de 30 à 40 % (environ 50 % pour le risque des FESF) (tableau 7.1).
Les traitements anti-ostéoporotiques freinent la résorption osseuse ou stimulent la for-mation osseuse. Ils diminuent le risque de fracture vertébrale d’environ 40 à 70 % (en fonction des médicaments et de la gravité de l’ostéoporose) et le risque de fracture péri-phérique de 30 à 40 % (environ 50 % pour le risque des FESF) (tableau 7.1).
Médicaments freinant la résorption osseuse
Traitement hormonal de la ménopause
Le traitement hormonal de ménopause (THM) est indiqué pour la prise en charge des troubles climatériques chez les femmes ménopausées âgées de 50 à 60 ans. Ce traite-ment diminue le risque de fracture vertébrale. La durée de sa prescription est fonction du rapport bénéfice-risque, à discuter avec la patiente et à réévaluer régulièrement. Les risques sont l’augmentation du risque thromboembolique et du risque de néoplasie mammaire.
Raloxifène
Le raloxifène appartient à la classe des SERM (modulateurs sélectifs du récepteur aux œstrogènes). Il augmente modérément la DMO et diminue l’incidence des fractures ver-tébrales. Il est prescrit à la dose de 60 mg par jour. Il est contre-indiqué en cas d’antécédent thromboembolique et peut parfois accentuer les bouffées de chaleur. Le ra-loxifène diminue également le risque de survenue d’un cancer du sein hormonodépen-dant. Il est utilisé chez la femme ménopausée de moins de 70 ans.
Bisphosphonates
Ils sont anti-ostéoclastiques et freinent le remodelage osseux, augmentent la DMO et di-minuent l’incidence des fractures vertébrales et périphériques dont la FESF. Ils sont utili-sés chez les hommes et les femmes ménopausées sans limite d’âge.
Les bisphosphonates oraux comprennent :
Pour améliorer l’absorption intestinale, les bisphosphonates oraux doivent être pris le matin, à jeun, avec un verre d’eau du robinet et au moins 30 minutes avant la prise du petit déjeuner et des autres médicaments.
Une nouvelle formulation du risédronate dite gastrorésistante permet une prise à la fin du petit-déjeuner.
Les bisphosphonates oraux ont été associés à un risque augmenté d’œsophagite ; ainsi pour éviter un éventuel reflux gastro-œsophagien après la prise du médicament, il est demandé au patient de ne pas se recoucher ni se pencher en avant au cours des 30 minutes suivant la prise du médicament.
L’acide zolédronique (5 mg) est un bisphosphonate administré par voie intraveineuse une fois par an. Après 3 années de traitement, le risque de fracture vertébrale est diminué de 70 % et le risque de fracture périphérique de 40 % chez les femmes ménopausées. Son principal effet secondaire est la survenue d’un syndrome pseudo-grippal dans les 24 à 48 heures suivant la perfusion qui peut être atténué par la prise de paracétamol et une bonne hydratation orale voire de dexaméthasone.
La principale contre-indication à l’utilisation des bisphosphonates est l’insuffisance ré-nale, il faut donc s’assurer d’une clairance de la créatinine supérieure à 30 ml/min avant leur utilisation.
Les bisphosphonates (surtout IV) augmentent le risque d’ostéonécrose de la mâchoire. L’incidence de cet événement indésirable est très faible (environ 1 pour 10 000 par an) lorsque les bisphosphonates sont utilisés aux doses anti-ostéoporotiques — ce qui est différent de leur utilisation en oncologie. Les patients sous bisphosphonates doivent comme dans la population générale avoir un suivi régulier chez leur dentiste pour traiter les foyers infectieux dentaires chroniques.
Dénosumab
Le dénosumab est une biothérapie ciblant le RANKL (anticorps monoclonal anti-RANKL) ayant une action inhibitrice de la résorption osseuse. Il augmente durablement la DMO et diminue l’incidence des fractures vertébrales et périphériques dont la FESF. Il s’administre par voie sous-cutanée (à la posologie de 60 mg) tous les 6 mois. En France, il est remboursé dans l’ostéoporose post-ménopausique sans limite d’âge en relais d’un traitement par bisphosphonates notamment en cas d’échec ou de mauvaise tolérance aux bisphosphonates. Il n’est donc pas prescrit en première intention.
Il n’est pas contre-indiqué en cas d’insuffisance rénale. Il est contre-indiqué en cas d’hypocalcémie. Comme les bisphosphonates, il est associé à un risque d’ostéonécrose de la mâchoire.
Il existe un phénomène de rebond à son arrêt avec une augmentation du risque fractu-raire qui impose un relais par un bisphosphonate. Sa prescription initiale doit être réalisée par un médecin spécialiste de la prise en charge de l’ostéoporose.
Médicament stimulant la formation osseuse
Tériparatide
Le tériparatide est le fragment recombinant 1–34 de la parathormone. Ce fragment est ostéoformateur lorsqu’il est administré quotidiennement par voie sous-cutanée à la dose de 20 µg par jour pendant une durée de 18 à 24 mois. Sa prescription s’intègre dans un traitement séquentiel car, à l’issue de cette durée, un relais doit être systématiquement pris par un traitement anti-résorbeur. Le tériparatide augmente le remodelage osseux au bénéfice de la formation osseuse et induit une augmentation de la DMO et une diminution de l’incidence des fractures vertébrales et non vertébrales. Il est remboursé pour les formes sévères avec au moins deux fractures vertébrales chez la femme ménopausée et l’homme, sans limite d’âge. Son utilisation est contre-indiquée en cas d’hypercalcémie, de maladies métaboliques osseuses autres que l’ostéoporose, d’antécédent de radiothé-rapie et en cas de tumeur osseuse ou de métastases.
Romosozumab
![]() Le romosozumab est un anticorps monoclonal anti-sclérostine. Il a un double effet ostéoformateur et anti-résorptif. Son indication est limitée aux femmes ménopausées âgées de moins de 75 ans avec un antécédent de fracture sévère et sans antécédent de coronaropathie. La prescription du romosozumab en France est limitée car non remboursée ; la seule possibilité d’obtenir le romosozumab à l’heure actuelle se fait par une pharmacie hospitalière, sur demande hautement justifiée et en nombre limité.
Le romosozumab est un anticorps monoclonal anti-sclérostine. Il a un double effet ostéoformateur et anti-résorptif. Son indication est limitée aux femmes ménopausées âgées de moins de 75 ans avec un antécédent de fracture sévère et sans antécédent de coronaropathie. La prescription du romosozumab en France est limitée car non remboursée ; la seule possibilité d’obtenir le romosozumab à l’heure actuelle se fait par une pharmacie hospitalière, sur demande hautement justifiée et en nombre limité.
Tableau 7.1. ![]()
![]() Principaux traitements médicamenteux de l’ostéoporose.
Principaux traitements médicamenteux de l’ostéoporose.
| Classe thérapeutique | Forme | Mode d'action | Indication (AMM) | Remboursement | Restriction d’indication ou de remboursement | Spécificité |
|---|---|---|---|---|---|---|
| THM | Gel, patch, oral | AR | Femmes MP | Oui | Si troubles climatériques | |
| SERM Raloxifène | Oral | AR | Femmes MP | Oui | Avant 70 ans | |
| Bisphosphonates : risédronate | Oral | AR | Femmes MP | Oui | ||
| Hommes | Oui | |||||
| Bisphosphonates : alendronate | Oral | AR | Femmes MP | Oui | ||
| Bisphosphonates : acide zolédronique | IV | AR | Femmes MP | Oui | ||
| Hommes | Oui | |||||
| Dénosumab | SC | AR | Femmes MP | Oui | En deuxième intention, en relais d’un traitement par bisphosphonates | Nécessité d’un relais par bisphosphonates |
| Hommes | Non | |||||
| Tériparatide | SC | OF | Femmes MP | Oui | Si au moins deux fractures vertébrales | À relayer par un anti-résorbeur |
| Hommes | Oui | |||||
| Romosozumab | SC | AR+OF | Femmes < 75 ans | Non | À relayer par un anti-résorbeur | |
| AR : anti-résorbeur ; OF : ostéoformateur ; MP : ménopausée ; IV : intraveineux ; SC : sous-cutanée. | ||||||
![]() Seuls le risédronate, l’acide zolédronique et le tériparatide font l’objet d’une AMM en France et d’un remboursement. Le dénosumab peut être prescrit mais n’est pas remboursé.
Seuls le risédronate, l’acide zolédronique et le tériparatide font l’objet d’une AMM en France et d’un remboursement. Le dénosumab peut être prescrit mais n’est pas remboursé.
Les altérations du métabolisme phosphocalcique et du remodelage osseux de l’insuffisant rénal chronique terminal (clairance de la créatinine < 30 ml/min) ou du dialysé sont complexes. Les traitements sont contre-indiqués ou à adapter à la fonction rénale. La prise en charge de la fragilité osseuse dans ce contexte nécessite une concertation entre médecins néphrologues et rhumatologues.
Les mesures générales sont toujours indiquées dans la prise en charge de l’ostéoporose mais ne suffisent pas à elles seules car elles ne réduisent pas le risque de fracture ; il faut introduire un traitement anti-ostéoporotique pour réduire le risque de fracture.
La mesure de la DMO est utile pour prendre une décision thérapeutique et pour le suivi thérapeutique.
Une DMO basse est un facteur de risque de fracture et de refracture mais une fracture ostéoporotique peut survenir quel que soit le T-score de DMO.
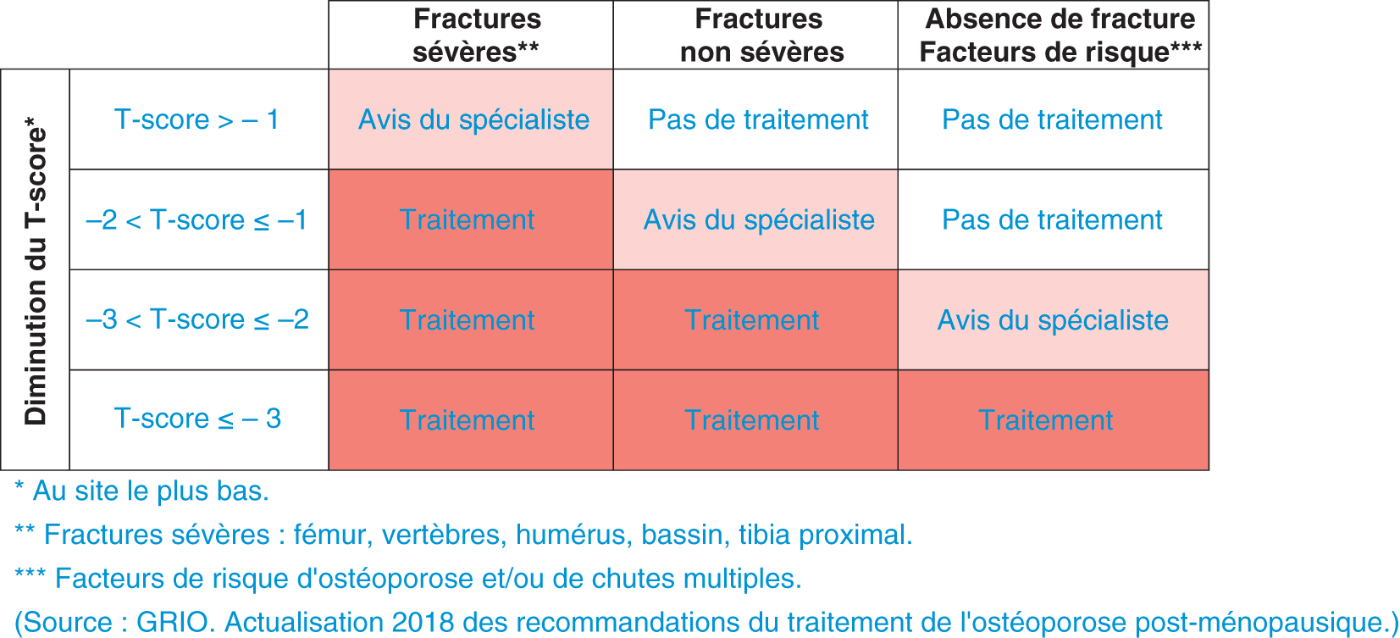
On peut distinguer plusieurs situations (tableau 7.2).
Tableau 7-2. ![]() Indications thérapeutiques dans l’ostéoporose post-ménopausique, selon les recommandations de la Société française de rhumatologie.
Indications thérapeutiques dans l’ostéoporose post-ménopausique, selon les recommandations de la Société française de rhumatologie.
Devant une fracture sévère (vertèbre, FESF, FESH, bassin)
Un traitement est impératif quel que soit l'âge si le T-score est ≤ – 1.![]() En cas de fracture non vertébrale, le choix peut se porter sur un bisphosphonate per os ou injectable ou encore le dénosumab (intolérance ou échec des bisphosphonates).
En cas de fracture non vertébrale, le choix peut se porter sur un bisphosphonate per os ou injectable ou encore le dénosumab (intolérance ou échec des bisphosphonates).
En cas de fracture vertébrale, le choix peut se porter sur un bisphosphonate per os ou injectable ou le dénosumab ou le raloxifène (à réserver aux patientes avec un risque de fracture périphérique peu élevé, remboursé jusqu’à 70 ans), le tériparatide (≥ 2 fractures vertébrales) et le THM (si troubles climatériques et si entre 50 et 60 ans).
En cas de T-score> – 1, il convient de se poser la question de l’origine de la fracture car il est rare qu’en cas de fracture sévère ostéoporotique tous les T-scores de DMO soient supérieurs à – 1 ; l’avis d’un spécialiste de pathologie osseuse et l’usage d’outils de prédiction tels que le FRAX® peuvent être recommandés.
Devant une fracture sévère, à la suite d’un traumatisme de faible énergie, la mesure de DMO est importante pour connaître la sévérité de l’ostéoporose et pour le suivi du traite-ment.
Chez le sujet très âgé et difficilement mobilisable, le traitement de l’ostéoporose prime sur la mesure de DMO et le traitement peut dans ce cas être instauré sans réalisation d’une ostéodensitométrie.
Devant une fracture non sévère
![]() On propose un traitement en tenant compte de l’ensemble des facteurs de risque, notamment du T-score de DMO :
On propose un traitement en tenant compte de l’ensemble des facteurs de risque, notamment du T-score de DMO :
– si l’un des T-score est ≤ – 2, il est recommandé d’instaurer un traitement ;
– si – 2 <T-score≤ – 1, l’avis d’un spécialiste de pathologie osseuse et l’usage d’outils de prédiction tels que le FRAX® peuvent être recommandés ;
– en cas de T-score > – 1, il n’est pas recommandé de prescrire un traitement anti-ostéoporotique.![]() Le choix peut se porter sur un bisphosphonate per os ou injectable, le raloxifène (à réserver aux patientes avec un risque de fracture périphérique peu élevé), le dénosumab et le THM (si troubles climatériques et si entre 50 et 60 ans).
Le choix peut se porter sur un bisphosphonate per os ou injectable, le raloxifène (à réserver aux patientes avec un risque de fracture périphérique peu élevé), le dénosumab et le THM (si troubles climatériques et si entre 50 et 60 ans).
![]() Un traitement est mis en route si T-score ≤ – 3.
Un traitement est mis en route si T-score ≤ – 3.
Le choix peut se porter sur un bisphosphonate per os ou injectable, du raloxifène (à réserver aux patientes avec un risque de fracture périphérique peu élevé), du dénosumab et le THM (si troubles climatériques et si entre 50 et 60 ans).
![]() En cas de corticothérapie prolongée, le risque de fracture est très élevé, en particulier chez la femme ménopausée.
En cas de corticothérapie prolongée, le risque de fracture est très élevé, en particulier chez la femme ménopausée.
En cas de corticothérapie prolongée (≥ 3 mois), chez les femmes ménopausées et les hommes ≥ 50 ans, un traitement par bisphosphonate per os ou injectable ou du téripara-tide (si ≥ 2 fractures vertébrales) sera prescrit si :
Il est recommandé de réaliser une mesure de DMO en début de corticothérapie prolongée afin d’évaluer le risque de fracture du patient et la durée de traitement anti-ostéoporotique, mais la décision de mettre en route un traitement anti-ostéoporotique chez les plus de 50 ans est indépendante de la DMO dès lors que la corticothérapie est ≥ 7,5 mg par jour pendant ≥ 3 mois (comme dans la pseudopolyarthrite rhizomélique).
Chez les sujets de moins de 50 ans, la décision d’instaurer un traitement anti-ostéoporotique dépendra de l’ensemble des facteurs de risque d’ostéoporose et notamment des valeurs de DMO.
La perte osseuse liée à la corticothérapie est rapide, le traitement anti-ostéoporotique est à débuter rapidement. Il n’est donc pas toujours nécessaire d’attendre la réalisation de l’ostéodensitométrie pour débuter le traitement anti-ostéoporotique. La « traque » d’une fracture vertébrale est également indispensable, quelle que soit la perte de taille, car ce type de fracture est très fréquent.
![]() Il est indispensable. Il comporte le recueil des événements fracturaires, la recherche de nouveaux facteurs de risque et/ou de maladies inductrices d’ostéoporose, l’évaluation du risque de chute. La tolérance des traitements et l’adhésion thérapeutique sont à évaluer également. La taille est mesurée (une fois par an chez les sujets ostéoporotiques).
Il est indispensable. Il comporte le recueil des événements fracturaires, la recherche de nouveaux facteurs de risque et/ou de maladies inductrices d’ostéoporose, l’évaluation du risque de chute. La tolérance des traitements et l’adhésion thérapeutique sont à évaluer également. La taille est mesurée (une fois par an chez les sujets ostéoporotiques).
Une mesure de la DMO (si possible sur le même appareil que la première mesure) peut être proposée dans les 2 à 3 ans après le début du traitement et en fin de séquence de traitement (5 ans pour les bisphosphonates per os et 3 ans pour les bisphosphonates injectables). À la fin de la première séquence de traitement, la poursuite ou l’arrêt du trai-tement sont à évaluer selon certains critères (nouvelles fractures, DMO…).
Il existe des marqueurs biologiques du remodelage osseux capables d’évaluer l’activité de formation osseuse (ostéocalcine, phosphatases alcalines osseuses, peptides d’extension du procollagène Ι : P1NP) ou l’activité de résorption osseuse (télopeptides du collagène : CTX). Ces marqueurs sériques n’ont pas leur place dans le diagnostic ni le bilan initial d’une ostéoporose. Ils sont utiles lors du suivi de traitements par anti-résorbeurs pour évaluer l’observance à ces traitements et la réponse pharmacologique dès les premiers mois, avant les variations densitométriques.
L’évaluation morphologique du rachis est indiquée chez un patient traité s’il existe des rachialgies et/ou une perte de taille prospective ≥ 2 cm.
![]() L’ostéomalacie est une ostéopathie diffuse, raréfiante, fragilisante du tissu osseux caractérisée histologiquement par un important retard de minéralisation de la matrice organique nouvellement formée, ce qui conduit à une accumulation du tissu ostéoïde. Cet excès du tissu ostéoïde donne un caractère mou à l’os, diminuant sa résistance mécanique. Une concentration adéquate en calcium, en phosphore et en vitamine D est nécessaire à la minéralisation osseuse.
L’ostéomalacie est une ostéopathie diffuse, raréfiante, fragilisante du tissu osseux caractérisée histologiquement par un important retard de minéralisation de la matrice organique nouvellement formée, ce qui conduit à une accumulation du tissu ostéoïde. Cet excès du tissu ostéoïde donne un caractère mou à l’os, diminuant sa résistance mécanique. Une concentration adéquate en calcium, en phosphore et en vitamine D est nécessaire à la minéralisation osseuse.
Le terme de rachitisme est employé pour désigner l’ostéomalacie de l’enfant.
![]() L’ostéomalacie carentielle d’apport en vitamine D est devenue rare dans les pays développés. Elle peut s’observer notamment chez des migrants récents ou des personnes âgées ne bénéficiant pas, du fait de leurs conditions de vie, de leur mode d’habillement, d’une exposition au soleil ou d’apports alimentaires suffisants. L’ostéomalacie carentielle par malabsorption digestive est rare dans la population générale.
L’ostéomalacie carentielle d’apport en vitamine D est devenue rare dans les pays développés. Elle peut s’observer notamment chez des migrants récents ou des personnes âgées ne bénéficiant pas, du fait de leurs conditions de vie, de leur mode d’habillement, d’une exposition au soleil ou d’apports alimentaires suffisants. L’ostéomalacie carentielle par malabsorption digestive est rare dans la population générale.
La Elles peuvent être la conséquence :
Rappel : La source majeure de vitamine D n’est pas alimentaire (contenue surtout dans l’huile de foie de morue), mais provient de sa production cutanée sous l’effet du rayonnement UV qui transforme le 7-déhydrocholestérol présent dans la peau en vitamine D3. La vitamine D3 est transportée vers le foie par une protéine porteuse spé-cifique (D-binding protein) pour être hydroxylée en 25(OH)-vitamine D. Puis la 25(OH)-vitamine D est hydroxylée en 1,25(OH)2-vitamine D dans le tubule proximal rénal avant d’agir sur ses organes et cellules cibles.
La 25(OH)-vitamine D est considérée comme étant la principale forme circulante de ré-serve de la vitamine D, c’est la forme que l’on dose. La 1,25(OH)2-vitamine D est la forme biologiquement active.
L’une des fonctions primordiales de la 1,25(OH)2-vitamine D est de stimuler l’absorption intestinale du calcium et des phosphates.
Ces ostéomalacies ont en commun une hypophosphatémie chronique qui résulte d’une carence d’apport en phosphore (par exemple, nutrition parentérale) ou de pertes rénales excessives (par exemple, par diminution de leur taux de réabsorption tubulaire).
![]() Le taux de phosphate sanguin doit être dans des limites bien définies pour maintenir une minéralisation osseuse suffisante. La phosphatémie est régulée par plusieurs hormones dont la principale est le FGF-23 (facteur de croissance des fibroblastes 23). Lorsque le FGF-23 augmente, il induit une perte de phosphate par le rein et une baisse de phosphate dans le sang.
Le taux de phosphate sanguin doit être dans des limites bien définies pour maintenir une minéralisation osseuse suffisante. La phosphatémie est régulée par plusieurs hormones dont la principale est le FGF-23 (facteur de croissance des fibroblastes 23). Lorsque le FGF-23 augmente, il induit une perte de phosphate par le rein et une baisse de phosphate dans le sang.
![]() Les manifestations cliniques sont indépendantes de l'étiologie :
Les manifestations cliniques sont indépendantes de l'étiologie :
![]() Les signes radiologiques peuvent être manquants au début. Leur absence ne permet pas d'écarter le diagnostic. Ils sont indépendants de l'étiologie :
Les signes radiologiques peuvent être manquants au début. Leur absence ne permet pas d'écarter le diagnostic. Ils sont indépendants de l'étiologie :
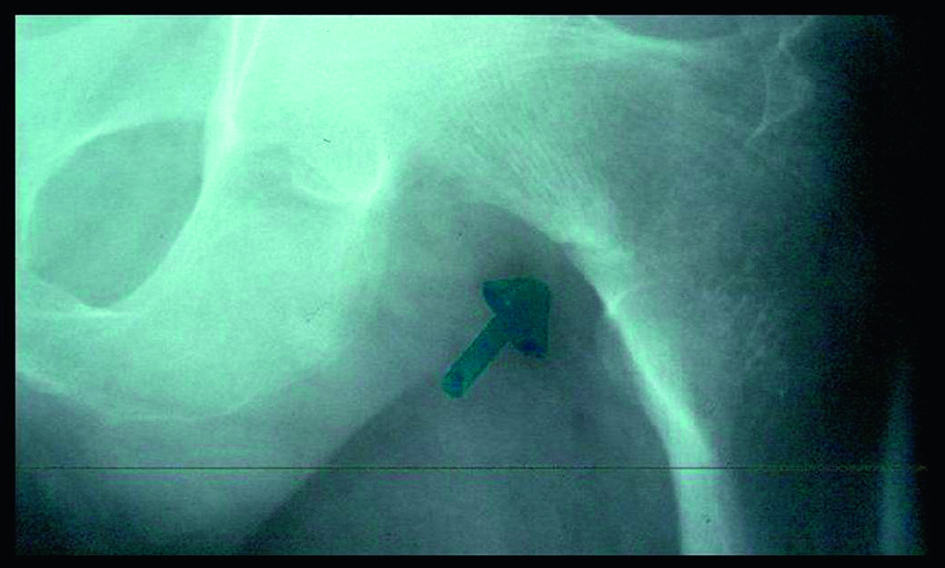
Fig. 7-7 :![]() Fissures ou stries de Looser-Milkman du col du fémur. La DMO met en évidence une diminution importante de la densité osseuse.
Fissures ou stries de Looser-Milkman du col du fémur. La DMO met en évidence une diminution importante de la densité osseuse.
![]() En cas d'ostéomalacie par carence en vitamine D, les arguments biologiques sont de grande valeur diagnostique et caractérisés par :
En cas d'ostéomalacie par carence en vitamine D, les arguments biologiques sont de grande valeur diagnostique et caractérisés par :
Le diagnostic de la carence en vitamine D repose sur le dosage de la 25(OH)-vitamine D. La carence en vitamine D est définie par une valeur de 25(OH)-vitamine D < 10 ng/ml [25 nmol/l]. L’insuffisance en vitamine D est définie par une valeur comprise entre 10 et 30 ng/ml [entre 25 et 75 nmol/l].
Actuellement, la concentration de 25(OH)-vitamine D recommandée est comprise entre 30 et 70 ng/ml [entre 75 et 175 nmol/l] et le risque d’intoxication en vitamine D, qui est exceptionnel, apparaît pour des concentrations supérieures à 150 ng/ml [375 nmol/l].![]() Le rapport de la HAS (2013) recommande de dépister une carence en vitamine D seulement dans les cas suivants :
Le rapport de la HAS (2013) recommande de dépister une carence en vitamine D seulement dans les cas suivants :
![]() Il faut adapter le traitement à chaque étiologie d’ostéomalacie (régime sans gluten en cas de maladie cœliaque, par exemple).
Il faut adapter le traitement à chaque étiologie d’ostéomalacie (régime sans gluten en cas de maladie cœliaque, par exemple).
En cas de défaut d’apport : correction de la carence en vitamine D et apport calcique suffisant pour normaliser la calcémie et fournir le calcium nécessaire à la reminéralisation du squelette.
Légende :
Dans le respect de la Réforme du deuxième cycle des études médicales (R2C), les connaissances rassemblées sur ce site sont hiérarchisées en rang A, rang B et rang C à l'aide de balises et d'un code couleur :
![]() Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
![]() Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
![]() Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).
