Arthropathie microcristalline
![]() Les rhumatismes microcristallins sont caractérisés par des dépôts intra-articulaires ou péri-articulaires de microcristaux. Ces dépôts peuvent rester asymptomatiques ou être à l'origine d'accès inflammatoires aigus ou, parfois, d'arthropathies chroniques liées à une inflammation persistante.
Les rhumatismes microcristallins sont caractérisés par des dépôts intra-articulaires ou péri-articulaires de microcristaux. Ces dépôts peuvent rester asymptomatiques ou être à l'origine d'accès inflammatoires aigus ou, parfois, d'arthropathies chroniques liées à une inflammation persistante.
L'inflammation microcristalline est l'archétype de l'inflammation aiguë en pathologie humaine.
Trois types de microcristaux sont en cause :
Les cristaux d'UMS et de PPC sont microscopiques et observables en microscopie optique. Ceux de phosphate de calcium sont submicroscopiques et ne peuvent pas être observés en microscopie optique.
L'inflammation des rhumatismes microcristallins repose sur une physiopathologie commune via l'activation intracellulaire de l'inflammasome NLRP3 lorsque les cellules de l'immunité innée (monocytes/macrophages) entrent en contact avec les microcristaux. Cette activation de l'inflammasome induit une production massive de cytokines pro-inflammatoires au premier rang desquelles l'IL-1 et l'IL-6, ce qui explique la brutalité et l'intensité des épisodes aigus.
Ainsi, les caractéristiques sémiologiques communes des accès microcristallins articulaires ou péri-articulaires typiques sont :
Cette description est valable pour la crise de goutte mais aussi pour les autres crises microcristallines.
Le site de l'arthrite ou de la péri-arthrite aiguë peut parfois orienter le diagnostic :
L'inflammation aiguë causée par les cristaux peut être à l'origine de signes généraux (fièvre, voire frissons) et d'une réaction inflammatoire biologique (élévation de la CRP, hyperleucocytose).
Ces signes peuvent faire craindre et suspecter une infection articulaire ? l'arthrite septique est le principal diagnostic différentiel (+++). Ils peuvent aussi correspondre à une infection associée, cause déclenchante classique d'un accès de goutte ou de rhumatisme à cristaux de PPC.
Les clés du diagnostic sont :
Une recherche de microcristaux doit être réalisée sur tout liquide articulaire d'arthrite aiguë ou d'arthrite récidivante inclassée.
Les rhumatismes microcristallins ont en revanche des spécificités de terrain, de diagnostic et de traitement.
![]() La prévalence de la goutte en France est de 0,9 % chez les adultes. La goutte est le rhumatisme inflammatoire intermittent le plus fréquent au monde, en particulier chez l'homme adulte.
La prévalence de la goutte en France est de 0,9 % chez les adultes. La goutte est le rhumatisme inflammatoire intermittent le plus fréquent au monde, en particulier chez l'homme adulte.
Le terrain du patient atteint de goutte est historiquement caricatural : homme mûr, souvent en surpoids ou obèse, qualifié de « bon vivant » avec volontiers une alimentation riche et une consommation excessive d'alcools (ou de sodas riches en fructose), atteint de maladies cardiovasculaires, d'insuffisance rénale et/ou de diabète sucré. Cette description en partie stigmatisante n'est toutefois que partiellement correcte, puisque l'hérédité a en fait une part prédominante de responsabilité dans la maladie, le poids de la génétique excédant largement celui de la diététique. L'association aux comorbidités cardiovasculaires (notamment insuffisance cardiaque chronique), l'insuffisance rénale chronique et le diabète, est importante.
La goutte est habituellement primitive, familiale avec une prédominance masculine. Divers éléments du syndrome métabolique sont fréquemment associés à la goutte : obésité avec augmentation du périmètre abdominal (> 94 cm chez l'homme européen et > 88 cm chez la femme), hypertension artérielle, intolérance au glucose ou diabète sucré, dyslipidémie avec diminution du HDL-cholestérol et hypertriglycéridémie.
Les patients goutteux sont donc à considérer à fort risque d'événements cardiovasculaires, qui expliquent la surmortalité observée notamment lorsque la goutte n'est pas correctement traitée.
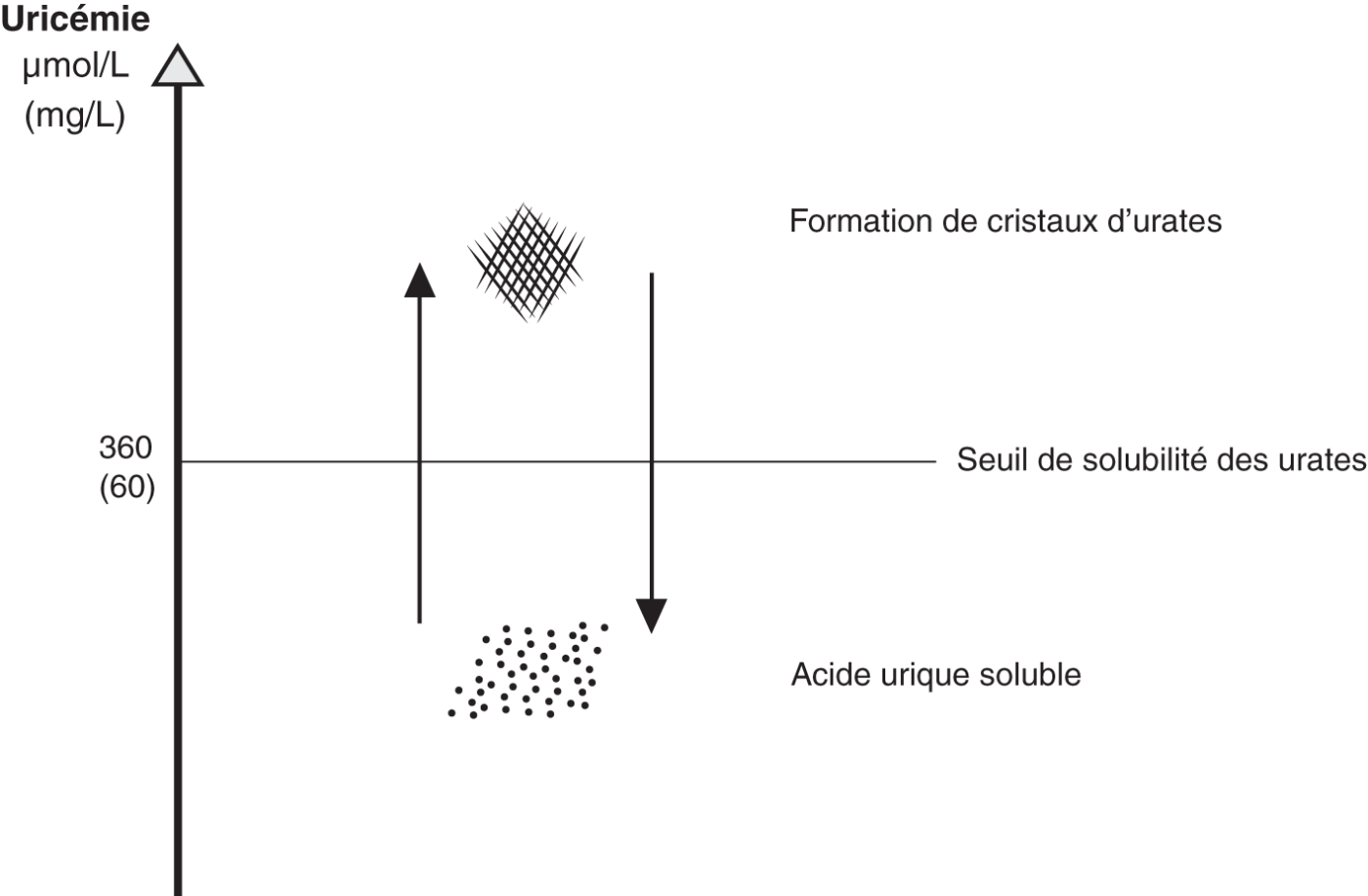
![]() La goutte résulte d'une hyperuricémie chronique supérieure à 360 µmol/l (60 mg/l), seuil de cristallisation de l'urate monosodique (UMS) à 35 °C (température des extrémités).
La goutte résulte d'une hyperuricémie chronique supérieure à 360 µmol/l (60 mg/l), seuil de cristallisation de l'urate monosodique (UMS) à 35 °C (température des extrémités).
La cristallisation va commencer progressivement au-dessus de ce seuil d'uricémie et s'intensifier avec son augmentation. Cette valeur correspond aussi à l'uricémie en dessous de laquelle il faudra amener et maintenir le patient après initiation d'un traitement hypo-uricémiant. Comme ce phénomène de cristallisation est réversible, abaisser l'uricémie en dessous de cette valeur permet la dissolution des cristaux déjà formés (fig. 19.1). Cependant, l'objectif thérapeutique sera à moins de 300 µmol/l pour tout le monde, pour être sûr d'être en dessous de la cible « chimique » et ainsi assurer une dissolution efficace des cristaux.
Les microcristaux d'UMS libérés dans les articulations sont responsables d'accès articulaires aigus (puis chroniques) via l'activation de l'inflammasome NLRP3 et, avec le temps, de la constitution de dépôts d'UMS en amas dans les tissus mous péri-articulaires (tophus goutteux). L'arthropathie goutteuse est une manifestation chronique correspondant à la destruction des articulations et est la conséquence de l'inflammation chronique induite par les tophus au contact du tissu osseux.
Fig. 19.1. ![]() Principe de formation de cristaux d'urate ou d'acide urique soluble selon l'uricémie.
Principe de formation de cristaux d'urate ou d'acide urique soluble selon l'uricémie.
![]() Dans les urines, le pH peut être acide (inférieur à 6), ce qui, en cas d'hyperuricurie, facilite la cristallisation de l'acide urique et la formation de lithiases (radiotransparentes car non calciques), pouvant donner des crises de colique néphrétique. En cas de chronicisation, des dépôts d'urate peuvent se former dans la médulla rénale et être à l'origine d'une maladie rénale obstructive (néphropathie uratique).
Dans les urines, le pH peut être acide (inférieur à 6), ce qui, en cas d'hyperuricurie, facilite la cristallisation de l'acide urique et la formation de lithiases (radiotransparentes car non calciques), pouvant donner des crises de colique néphrétique. En cas de chronicisation, des dépôts d'urate peuvent se former dans la médulla rénale et être à l'origine d'une maladie rénale obstructive (néphropathie uratique).
![]() Les causes de l'hyperuricémie à l'origine d'une goutte sont bien identifiées et sont regroupées en deux grandes familles :
Les causes de l'hyperuricémie à l'origine d'une goutte sont bien identifiées et sont regroupées en deux grandes familles :
Seuls 10 à 15 % des sujets hyperuricémiques développent une goutte.
Le risque de goutte augmente avec la durée et l'intensité de l'hyperuricémie mais même une uricémie à 100 mg/l ne s'accompagne de goutte que chez 50 % des sujets seulement après 15 ans de suivi. Cela justifie actuellement de ne pas traiter une hyperuricémie asymptomatique.
![]() Les causes de la goutte ne se limitent donc pas à celles de l'hyperuricémie : d'autres mécanismes encore non élucidés participent à la cristallisation de l'UMS et à l'hyper-réactivité inflammatoire à la présence des cristaux d'UMS.
Les causes de la goutte ne se limitent donc pas à celles de l'hyperuricémie : d'autres mécanismes encore non élucidés participent à la cristallisation de l'UMS et à l'hyper-réactivité inflammatoire à la présence des cristaux d'UMS.
![]() La goutte peut donner lieu aux manifestations suivantes.
La goutte peut donner lieu aux manifestations suivantes.
Si la goutte n'est pas traitée, des arthropathies chroniques peuvent se constituer. Elles se traduisent par des douleurs mécaniques et/ou inflammatoires chroniques émaillées de crises inflammatoires, liées aux lésions articulaires secondaires à l'inflammation chronique et à la stimulation inflammatoire persistante par les cristaux d'UMS (fig. 19.2).
Fig. 19.2. ![]() Arthropathie uratique de l'articulation métatarsophalangienne de l'hallux (radiographie).
Arthropathie uratique de l'articulation métatarsophalangienne de l'hallux (radiographie).
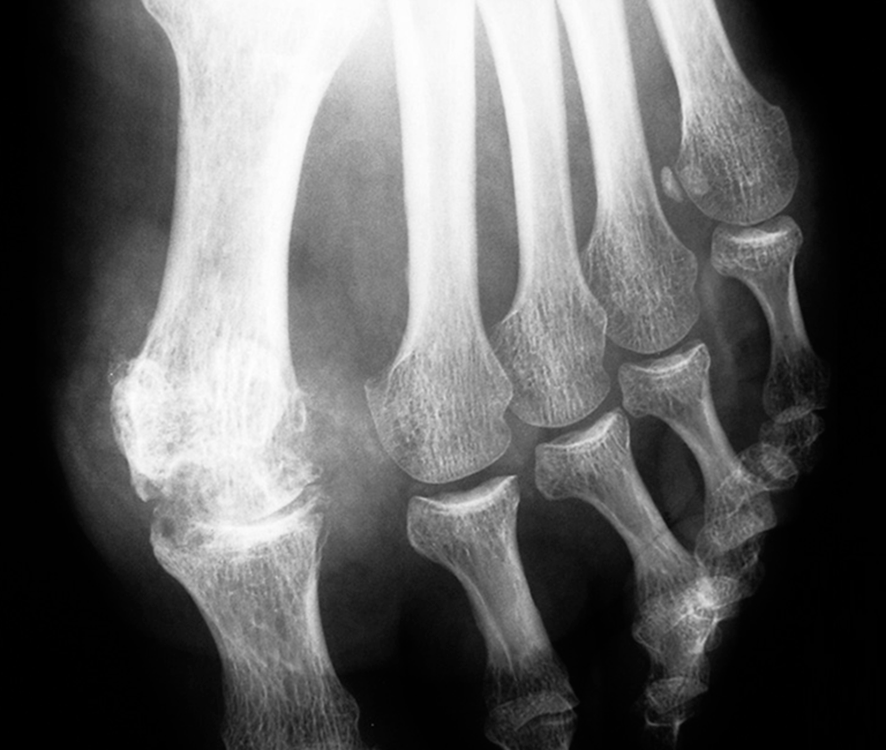
Les érosions (encoches épiphysaires) se font en regard de tophus (épaississements radio-opaques des tissus mous). L'interligne articulaire est longtemps préservé avant l'apparition d'un pincement articulaire et d'une ostéophytose marginale, comme sur cet exemple.
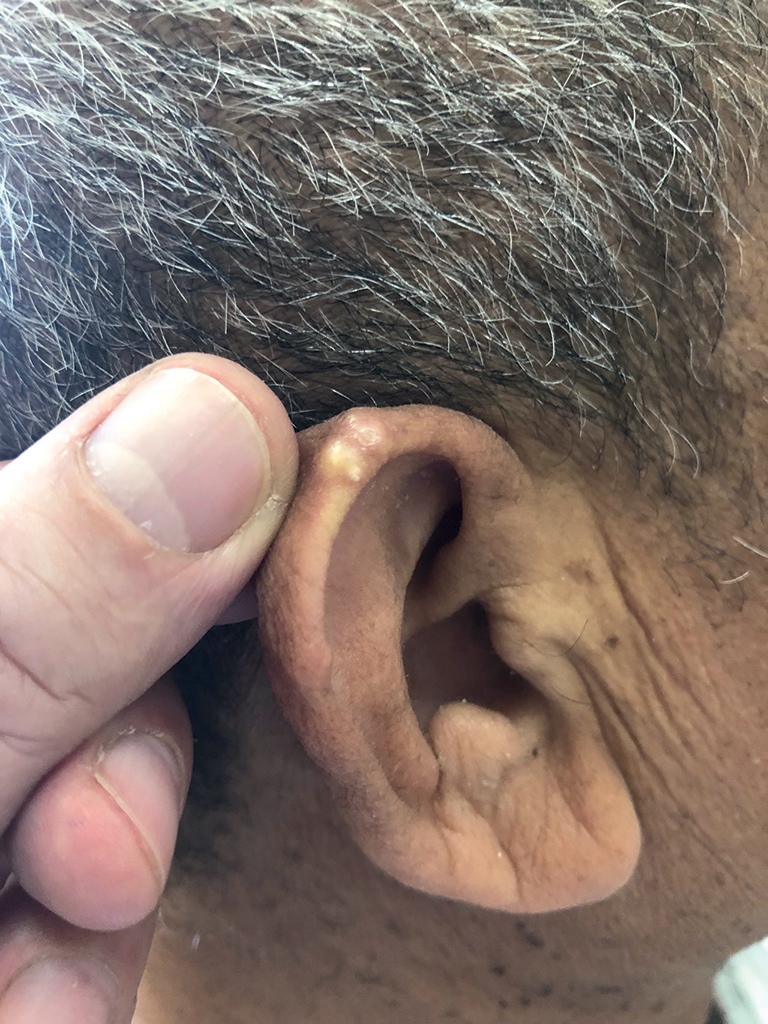
Fig. 19.3. ![]() Tophus goutteux du pavillon de l'oreille droite.
Tophus goutteux du pavillon de l'oreille droite.
Le diagnostic de la goutte repose sur la mise en évidence de microcristaux d'UMS (![]() cristaux fins, allongés, pointus, fortement biréfringents en lumière polarisée) dans le liquide articulaire ou dans un tophus : c'est l'examen de référence.
cristaux fins, allongés, pointus, fortement biréfringents en lumière polarisée) dans le liquide articulaire ou dans un tophus : c'est l'examen de référence.
En l'absence de mise en évidence du cristal (« preuve microcristalline »), le diagnostic repose sur un faisceau d'arguments :
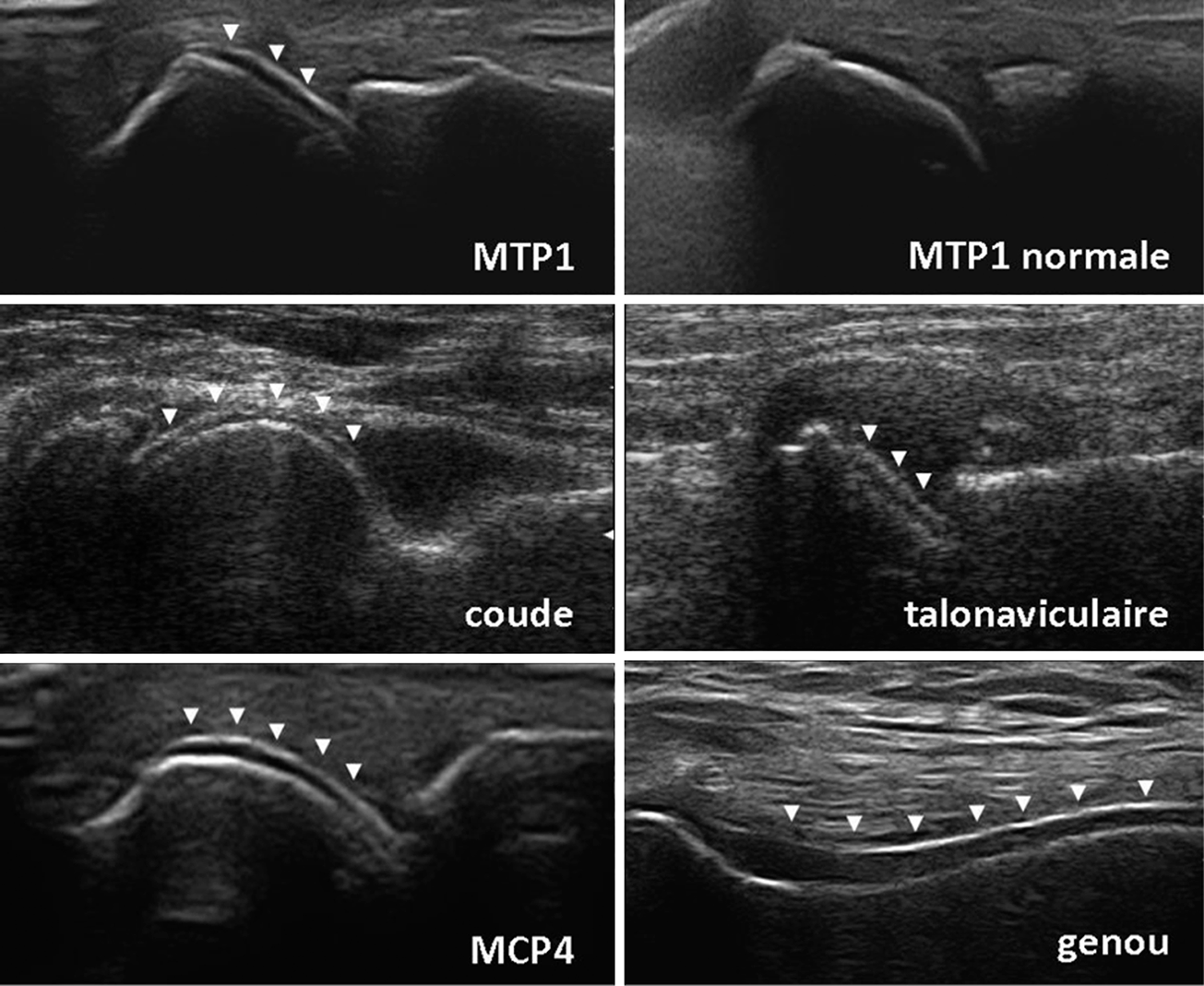
Fig. 19.4. ![]() Aspects échographiques dits en « double contour » à la surface du cartilage (dépôts de cristaux d'urate).
Aspects échographiques dits en « double contour » à la surface du cartilage (dépôts de cristaux d'urate).
![]() Les examens suivants sont faits à visée préthérapeutique et bilan de comorbidités :
Les examens suivants sont faits à visée préthérapeutique et bilan de comorbidités :
Fig. 19.5. ![]() Différents aspects échographiques de tophus goutteux.
Différents aspects échographiques de tophus goutteux.
A. Tophus fusiforme hyperéchogène du tendon rotulien. B. Tophus (astérisque) isoéchogène du tendon rotulien à son insertion distale avec atténuation des ultrasons (double flèche). C. Tophus de la 1re MTP avec un aspect de masse isoéchogène (astérisque) associé à une atténuation postérieure (double flèche) et un halo hypoéchogène péri-tophacé. D. Tophus (astérisque) intra-articulaire du poignet avec spots hyperéchogènes intra-tophacés évocateurs.
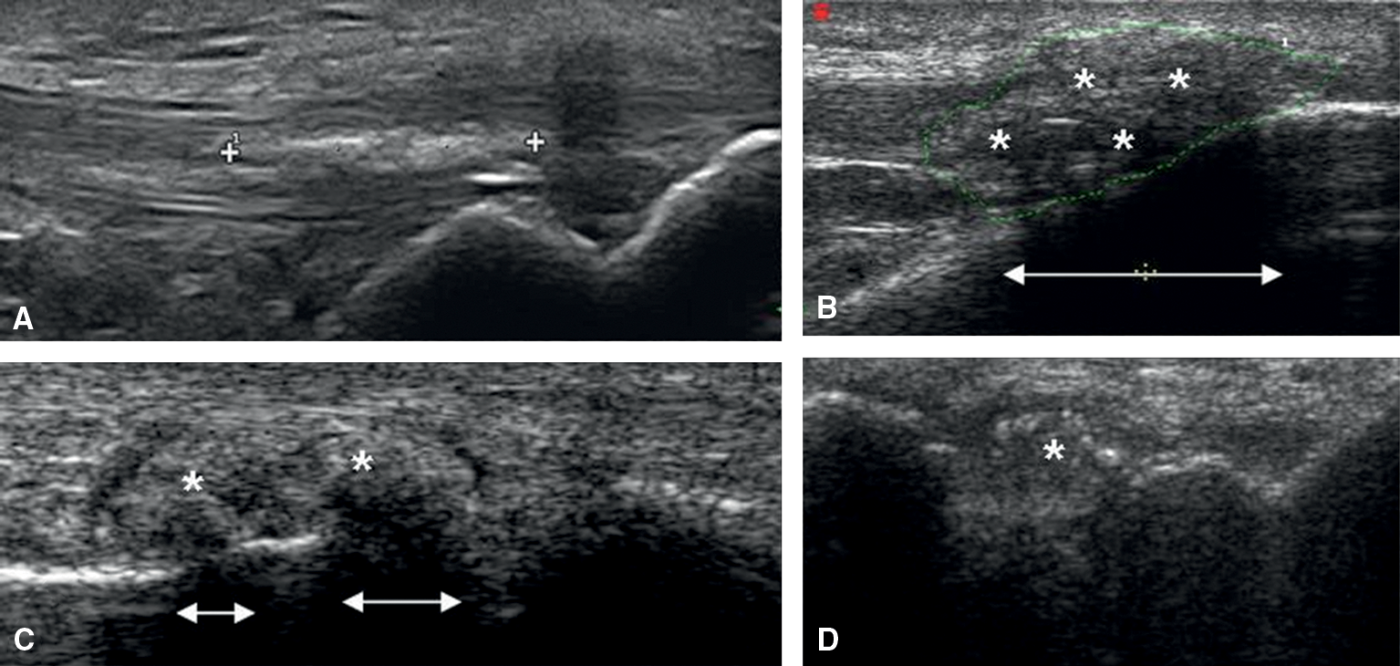
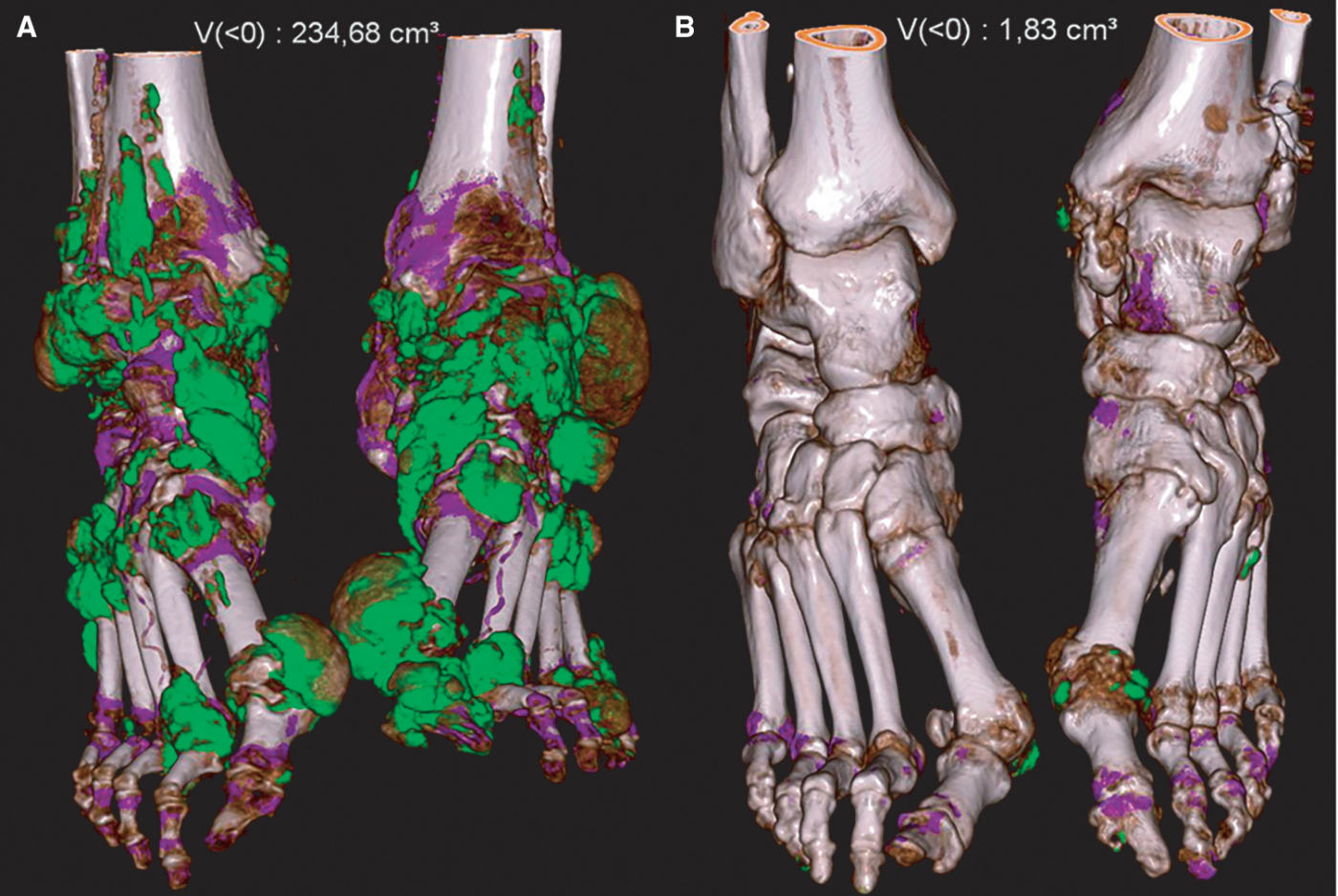
Fig. 19.6. ![]() Aspect en scanner double-énergie de tophus sous-cutanés extensifs (A) et modérés (B) du pied, codés en vert.
Aspect en scanner double-énergie de tophus sous-cutanés extensifs (A) et modérés (B) du pied, codés en vert.
Quatre principes simples président à la prise en charge, fondée sur l'éducation du patient.
![]() D'autres moyens peuvent être associés : repos (orthèse) et glaçage articulaire (avec protection cutanée, qui raccourcit la durée de l'accès), médicaments antalgiques.
D'autres moyens peuvent être associés : repos (orthèse) et glaçage articulaire (avec protection cutanée, qui raccourcit la durée de l'accès), médicaments antalgiques.
Quatre recommandations simples sont à mettre en ?uvre.
Recommandation 1
La colchicine doit être initiée le plus tôt possible, idéalement dans les 12 premières heures, à la posologie suivante :
Il faut dire au malade d'avoir la colchicine à portée de main : « dans la poche » ou « sur la table de nuit ».
![]() La diarrhée est le premier signe de toxicité de la colchicine et doit faire diminuer ou arrêter le traitement. Les associations avec ralentisseur du transit sont donc déconseillées (comme dans le Colchimax® qui contient aussi un anticholinergique).
La diarrhée est le premier signe de toxicité de la colchicine et doit faire diminuer ou arrêter le traitement. Les associations avec ralentisseur du transit sont donc déconseillées (comme dans le Colchimax® qui contient aussi un anticholinergique).
La posologie de la colchicine doit être diminuée chez l'insuffisant rénal (contre-indiquée en cas de DFG < 30 ml/min/1,73 m2) et en cas de co-prescription de médicaments qui interfèrent avec son métabolisme (association aux macrolides et pristinamycine contre-indiquée du fait du risque d'agranulocytose).
![]() Des précautions d'emploi sont à observer en association avec les statines (majoration et potentialisation des effets indésirables musculaires).
Des précautions d'emploi sont à observer en association avec les statines (majoration et potentialisation des effets indésirables musculaires).
Recommandation 2
![]() La corticothérapie orale doit être prescrite dès le début de la crise (
La corticothérapie orale doit être prescrite dès le début de la crise (![]() à la dose de 30 à 35 mg par jour équivalent prednisone pendant 3 à 5 jours). Elle est déconseillée en cas de diabète de type 2 ou d'hypertension artérielle déséquilibrés.
à la dose de 30 à 35 mg par jour équivalent prednisone pendant 3 à 5 jours). Elle est déconseillée en cas de diabète de type 2 ou d'hypertension artérielle déséquilibrés.
La corticothérapie intra-articulaire doit être privilégiée pour le traitement d'une arthrite facilement accessible à un geste local, une fois l'hypothèse septique formellement éliminée.
Recommandation 3
Les AINS doivent être prescrits per os dès le début de la crise et sur une courte période, le temps de la crise. Ils doivent être évités en cas d'insuffisance rénale de stade 3 à 5 ou de maladie cardiovasculaire sévère. En effet, les nombreuses comorbidités associées à la goutte sont autant de contre-indications aux AINS, qui sont donc très fréquentes dans cette population. Ils sont aussi contre-indiqués chez le transplanté rénal, chez la personne âgée ou tout malade sous médicament anticoagulant (AVK, NACO).
Une durée de 3 à 5 jours est un maximum.
Recommandation 4
![]() Les inhibiteurs de l'IL-1 doivent être initiés en milieu hospitalier et réservés aux cas d'échec, de contre-indication ou d'intolérance aux AINS, aux corticostéroïdes et à la colchicine. Ils sont contre-indiqués en cas d'infection et doivent faire surveiller les polynucléaires neutrophiles.
Les inhibiteurs de l'IL-1 doivent être initiés en milieu hospitalier et réservés aux cas d'échec, de contre-indication ou d'intolérance aux AINS, aux corticostéroïdes et à la colchicine. Ils sont contre-indiqués en cas d'infection et doivent faire surveiller les polynucléaires neutrophiles.
![]() Le traitement hypo-uricémiant (THU) est le seul traitement permettant de mettre la goutte en rémission complète.
Le traitement hypo-uricémiant (THU) est le seul traitement permettant de mettre la goutte en rémission complète.
Deux principes sont à prendre en compte par le médecin (et le patient) :
Recommandation 1
Un traitement hypo-uricémiant (THU) permanent est indiqué dès que le diagnostic de goutte est retenu. Cela veut dire que le THU (allopurinol ou febuxostat) peut être proposé dès la première crise de goutte, une fois diagnostiquée.
Recommandation 2
L'uricémie doit être abaissée à moins de 300 µmol/l (50 mg/l), chez tous les goutteux. Une fois la cible atteinte, le traitement doit être maintenu et l'uricémie doit être contrôlée une à deux fois par an.
Recommandation 3
![]() Le choix du THU dépend de la fonction rénale et sera en première intention un inhibiteur de la xanthine oxydase : allopurinol ou febuxostat :
Le choix du THU dépend de la fonction rénale et sera en première intention un inhibiteur de la xanthine oxydase : allopurinol ou febuxostat :
L'utilisation du fébuxostat doit être prudente en cas de maladie cardiovasculaire sévère (insuffisance coronarienne instable ou antécédent d'infarctus myocardique, insuffisance cardiaque).
Recommandation 4
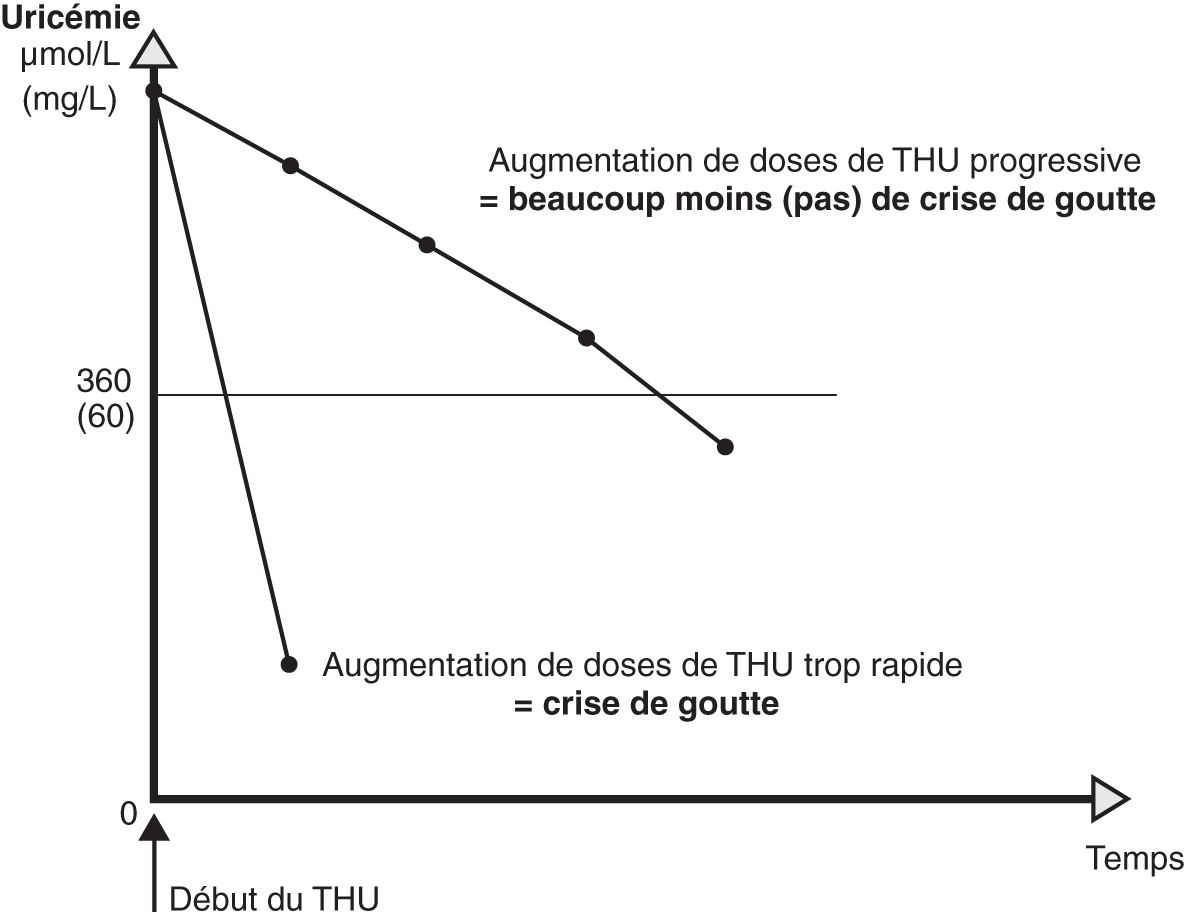
Fig. 19.7. ![]() Principe de la baisse lente de l'uricémie dans la prévention de crise de goutte modérée.
Principe de la baisse lente de l'uricémie dans la prévention de crise de goutte modérée.
Recommandation 5
![]() Les maladies et facteurs de risque cardiovasculaire, le syndrome métabolique et l'insuffisance rénale doivent être dépistés et pris en charge.
Les maladies et facteurs de risque cardiovasculaire, le syndrome métabolique et l'insuffisance rénale doivent être dépistés et pris en charge.
![]() Une hyperuricémie isolée n'est pas une indication à un traitement pharmacologique.
Une hyperuricémie isolée n'est pas une indication à un traitement pharmacologique.
Allopurinol
C'est un inhibiteur de la xanthine oxydase. La tolérance à l'allopurinol est habituellement bonne en particulier au long cours. Toutefois, dans les trois premiers mois de prescription, des réactions allergiques cutanées (éruption même mineure ou survenue rare mais grave d'hypersensibilité médicamenteuse à type de toxidermie, de syndrome de Lyell ou de DRESS, Drug Reaction with Eosinophilia and Systemic Symptoms) peuvent survenir. L'augmentation progressive des doses permet d'en diminuer le risque.
Ces éruptions, même minimes, imposent l'arrêt immédiat du médicament car l'issue peut être fatale et un avis médical doit être pris (à enseigner au patient) couplé au contrôle de la NFS, du DFGe et des tests hépatiques. La reprise du traitement est formellement contre-indiquée. Il faut savoir demander au patient s'il a fait dans le passé une allergie cutanée au Zyloric®, dénomination commerciale de l'allopurinol en DCI.
Fébuxostat
![]() C'est un puissant inhibiteur de la xanthine oxydase, mais non purinique. Il ne nécessite pas d'adaptation posologique tant que le DFGe reste > 30 ml/min. Il faut éviter le fébuxostat en cas d'insuffisance cardiaque d'origine coronarienne.
C'est un puissant inhibiteur de la xanthine oxydase, mais non purinique. Il ne nécessite pas d'adaptation posologique tant que le DFGe reste > 30 ml/min. Il faut éviter le fébuxostat en cas d'insuffisance cardiaque d'origine coronarienne.
![]() Le rhumatisme à pyrophosphate de calcium (PPC) est caractérisé par le dépôt dans les tissus articulaires (cartilage hyalin et fibrocartilage surtout) de cristaux de PPC. Ces dépôts peuvent être détectés en radiographie ; on parle alors de chondrocalcinose (au sens strict).
Le rhumatisme à pyrophosphate de calcium (PPC) est caractérisé par le dépôt dans les tissus articulaires (cartilage hyalin et fibrocartilage surtout) de cristaux de PPC. Ces dépôts peuvent être détectés en radiographie ; on parle alors de chondrocalcinose (au sens strict).
![]() La prévalence de cette chondrocalcinose augmente avec l'âge : rare avant 60 ans, 10 à 15 % entre 65 et 75 ans, plus de 30 % au-delà. La prédominance féminine diminue avec l'âge. La prévalence du rhumatisme (symptomatique) à cristaux de PPC reste en revanche méconnue, bien qu'il s'agisse de la cause la plus fréquente d'arthrites du sujet âgé.
La prévalence de cette chondrocalcinose augmente avec l'âge : rare avant 60 ans, 10 à 15 % entre 65 et 75 ans, plus de 30 % au-delà. La prédominance féminine diminue avec l'âge. La prévalence du rhumatisme (symptomatique) à cristaux de PPC reste en revanche méconnue, bien qu'il s'agisse de la cause la plus fréquente d'arthrites du sujet âgé.
Ce rhumatisme microcristallin est primitif dans la majorité des cas (aucune cause n'est mise en évidence).
![]() Des formes familiales très rares, souvent diffuses et sévères, doivent être évoquées et recherchées devant une chondrocalcinose radiographique volontiers diffuse diagnostiquée chez un sujet âgé de moins de 50 ans.
Des formes familiales très rares, souvent diffuses et sévères, doivent être évoquées et recherchées devant une chondrocalcinose radiographique volontiers diffuse diagnostiquée chez un sujet âgé de moins de 50 ans.
![]() Il existe toutefois des conditions pathologiques favorisant la formation de dépôts de cristaux de PPC. Les deux principales affections associées sont l'hémochromatose génétique et l'hyperparathyroïdie primaire. Le rhumatisme à PPC ou la chondrocalcinose radiologique peuvent amener à leur diagnostic : elles doivent être recherchées systématiquement par les dosages appropriés : ferritinémie et coefficient de saturation de la transferrine (> 45 %) et calcémie (voire dosage de PTH).
Il existe toutefois des conditions pathologiques favorisant la formation de dépôts de cristaux de PPC. Les deux principales affections associées sont l'hémochromatose génétique et l'hyperparathyroïdie primaire. Le rhumatisme à PPC ou la chondrocalcinose radiologique peuvent amener à leur diagnostic : elles doivent être recherchées systématiquement par les dosages appropriés : ferritinémie et coefficient de saturation de la transferrine (> 45 %) et calcémie (voire dosage de PTH).
Le traitement de la maladie associée ne change pas l'évolution du rhumatisme à cristaux de PPC.
![]() Il peut être asymptomatique, de découverte radiographique (alors appelée chondrocalcinose au sens strict).
Il peut être asymptomatique, de découverte radiographique (alors appelée chondrocalcinose au sens strict).
Il peut donner lieu à des manifestations articulaires polymorphes mimant volontiers d'autres rhumatismes :
![]() Un diagnostic positif est fait dans un contexte d'arthrite avec la mise en évidence dans le liquide articulaire de cristaux de PPC (
Un diagnostic positif est fait dans un contexte d'arthrite avec la mise en évidence dans le liquide articulaire de cristaux de PPC (![]() cristaux courts, carrés ou rectangulaires, négativement ou faiblement biréfringents) ou en cas de syndrome de la dent couronnée.
cristaux courts, carrés ou rectangulaires, négativement ou faiblement biréfringents) ou en cas de syndrome de la dent couronnée.
En dehors de ce contexte, le diagnostic repose sur un faisceau d'arguments :
Fig. 19.8. ![]() Rhumatisme à PPC.
Rhumatisme à PPC.
Calcification des ménisques et opacités linéaires dans l'interligne articulaire fémoro-tibial (radiographie du genou de face).
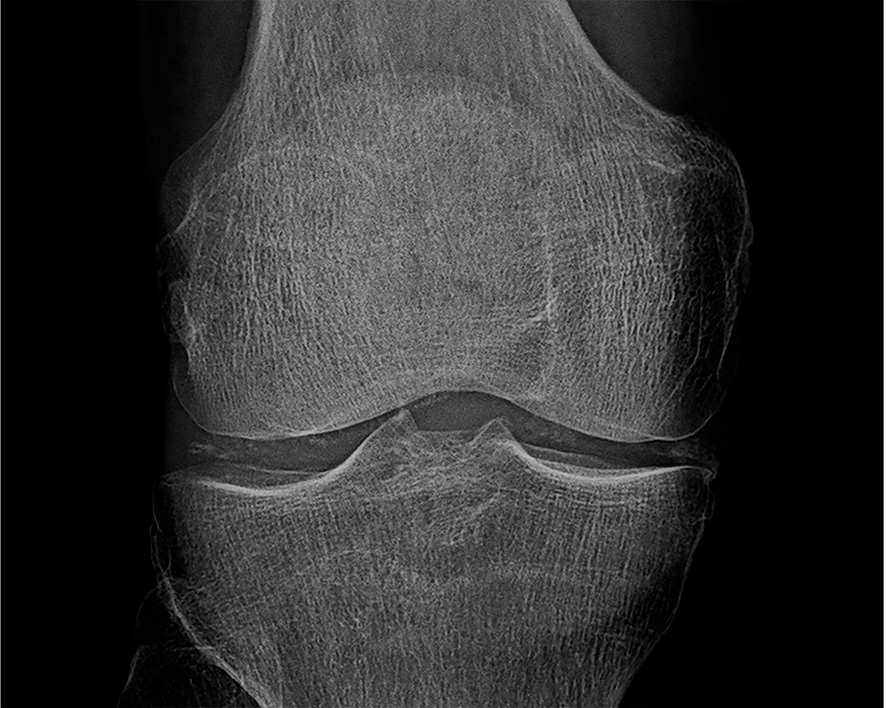
Fig. 19.9. ![]() Rhumatisme à PPC.
Rhumatisme à PPC.
Calcifications du ligament triangulaire du carpe et de l'interligne articulaire scaphotrapézien (radiographie du poignet de face).
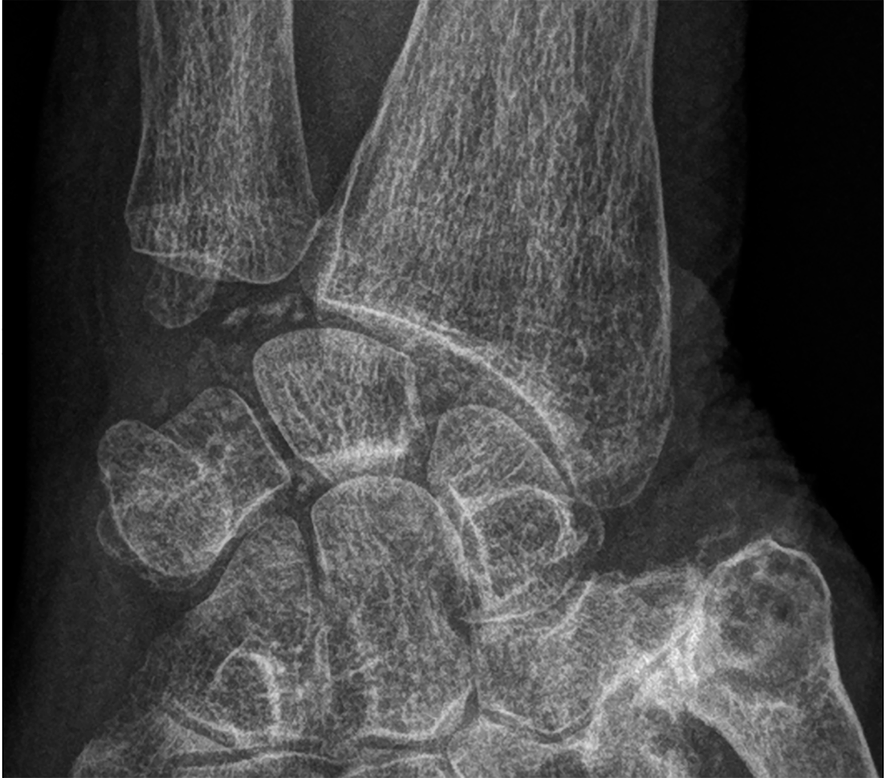
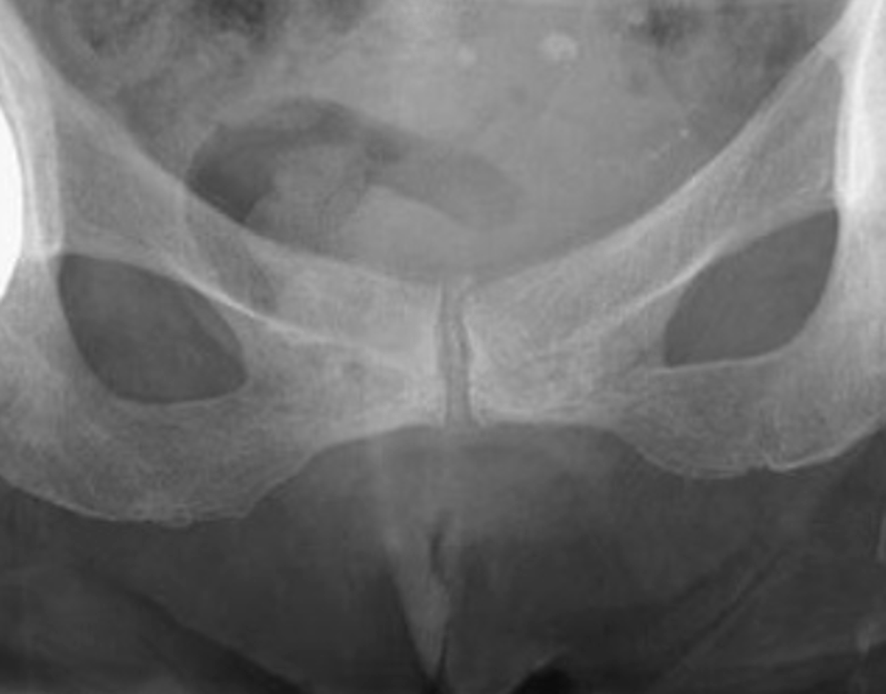
Fig. 19.10. ![]() Rhumatisme à PPC.
Rhumatisme à PPC.
Calcification de la symphyse pubienne (radiographie du bassin de face).
Les radiographies suivantes sont à prescrire en cas de suspicion de rhumatisme à PPC ou en cas d'une première crise pour préciser le caractère diffus ou localisé des dépôts :
Elles doivent toujours être bilatérales et comparatives : une arthrite d'un poignet à radiographie normale peut s'accompagner des dépôts calciques typiques sur la radiographie controlatérale.
![]() L'échographie articulaire : les dépôts de pyrophosphate de calcium peuvent apparaître sous la forme d'une fine bande ou de grains hyperéchogènes dans l'épaisseur du cartilage ou de points « scintillants » dans les fibrocartilages ou de calcifications méniscales hyperéchogènes.
L'échographie articulaire : les dépôts de pyrophosphate de calcium peuvent apparaître sous la forme d'une fine bande ou de grains hyperéchogènes dans l'épaisseur du cartilage ou de points « scintillants » dans les fibrocartilages ou de calcifications méniscales hyperéchogènes.
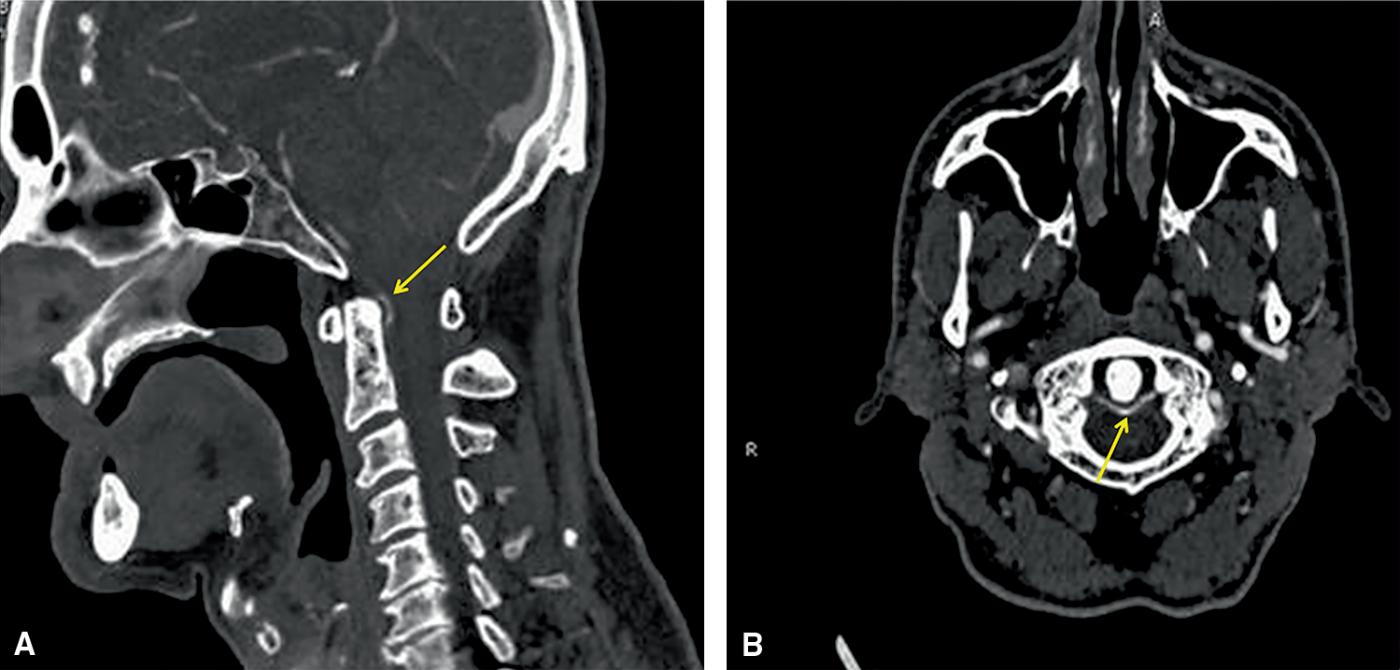
Le scanner articulaire peut permettre d'améliorer la sensibilité de détection de la chondrocalcinose par rapport à la radiographie standard. C'est l'examen de référence pour le diagnostic positif du syndrome de la dent couronnée (fig. 19.11).
Fig. 19.11. ![]() Rhumatisme à PPC.
Rhumatisme à PPC.
Coupes scanner du syndrome de la dent couronnée montrant une calcification du ligament péri-odontoïdien (flèches jaunes) en coupe sagittale (A) et axiale (B).
![]() Bilan des causes secondaires :
Bilan des causes secondaires :
![]() Le rhumatisme à hydroxyapatite est un rhumatisme plus souvent rencontré chez la femme jeune entre 30 et 50 ans. Il n'y a pas de facteur de risque connu et sa prévalence n'est pas connue.
Le rhumatisme à hydroxyapatite est un rhumatisme plus souvent rencontré chez la femme jeune entre 30 et 50 ans. Il n'y a pas de facteur de risque connu et sa prévalence n'est pas connue.
![]() Le rhumatisme à hydroxyapatite est dû à des dépôts de cristaux de la famille des apatites (cristaux de phosphate de calcium présents naturellement dans l'os), se formant de manière pathologique dans des structures péri-articulaires : tendons et bourses séreuses.
Le rhumatisme à hydroxyapatite est dû à des dépôts de cristaux de la famille des apatites (cristaux de phosphate de calcium présents naturellement dans l'os), se formant de manière pathologique dans des structures péri-articulaires : tendons et bourses séreuses.
Les dépôts peuvent être multiples ? on parle alors de maladie des calcifications tendineuses multiples ? mais siègent surtout à l'épaule (tendon du supra-épineux) et à la hanche (région trochantérienne ou para-acétabulaire).
![]() Des dépôts d'hydroxyapatite sont également observés dans les tissus sous-cutanés en situation ectopique comme les calcinoses du CREST et de la sclérodermie systémique, mais aussi des dermatomyosites et myosites auto-immunes, avec une physiopathologie de calcification toutefois différente de celle survenant dans les tendons du rhumatisme à hydroxyapatite.
Des dépôts d'hydroxyapatite sont également observés dans les tissus sous-cutanés en situation ectopique comme les calcinoses du CREST et de la sclérodermie systémique, mais aussi des dermatomyosites et myosites auto-immunes, avec une physiopathologie de calcification toutefois différente de celle survenant dans les tendons du rhumatisme à hydroxyapatite.
Le diagnostic repose sur un faisceau d'arguments alliant présentation clinique et mise en évidence des calcifications en imagerie, surtout par les radiographies standards (cf. chapitre 30) :
![]() L'échographie articulaire sera alors plus sensible pour détecter une calcification qui s'est résorbée en mettant en évidence des dépôts hyperéchogènes tendineux et/ou dans une bourse séreuse.
L'échographie articulaire sera alors plus sensible pour détecter une calcification qui s'est résorbée en mettant en évidence des dépôts hyperéchogènes tendineux et/ou dans une bourse séreuse.
Le syndrome inflammatoire biologique est inconstant mais peut être majeur.
L'épanchement intra-articulaire est le plus souvent de faible abondance et volontiers mécanique, sauf en cas de migration calcique intra-articulaire. La ponction articulaire n'est faite qu'en cas d'épanchement intra-articulaire important, qui doit faire évoquer un processus septique.
![]() Les cristaux sont trop petits pour être visibles en microscopie optique en lumière polarisée, il n'y a donc pas de ponction et d'analyse à la recherche de microcristaux du rhumatisme à hydroxyapatite en pratique clinique.
Les cristaux sont trop petits pour être visibles en microscopie optique en lumière polarisée, il n'y a donc pas de ponction et d'analyse à la recherche de microcristaux du rhumatisme à hydroxyapatite en pratique clinique.
![]() Le traitement comprend : repos, glaçage, AINS, voire corticothérapie orale (30 mg par jour) en cure courte de 3 à 5 jours. Les injections cortisoniques locales sont efficaces mais doivent être réalisées en seconde intention puisque l'évolution spontanée favorable est la règle. La colchicine semble avoir moins d'intérêt que dans les autres rhumatismes microcristallins.
Le traitement comprend : repos, glaçage, AINS, voire corticothérapie orale (30 mg par jour) en cure courte de 3 à 5 jours. Les injections cortisoniques locales sont efficaces mais doivent être réalisées en seconde intention puisque l'évolution spontanée favorable est la règle. La colchicine semble avoir moins d'intérêt que dans les autres rhumatismes microcristallins.
![]() Lorsque, devant une épaule douloureuse chronique résistant aux traitements usuels, on met en évidence une calcification du supra-épineux sans signe de rupture de coiffe, on peut proposer après avis d'un spécialiste rhumatologue de retirer la calcification causale par ponction-aspiration écho/radioguidée ou sous arthroscopie.
Lorsque, devant une épaule douloureuse chronique résistant aux traitements usuels, on met en évidence une calcification du supra-épineux sans signe de rupture de coiffe, on peut proposer après avis d'un spécialiste rhumatologue de retirer la calcification causale par ponction-aspiration écho/radioguidée ou sous arthroscopie.
Légende :
Dans le respect de la Réforme du deuxième cycle des études médicales (R2C), les connaissances rassemblées sur ce site sont hiérarchisées en rang A, rang B et rang C à l'aide de balises et d'un code couleur :
![]() Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
![]() Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
![]() Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).
