Polyarthrite rhumatoïde
![]() La polyarthrite rhumatoïde (PR) est le plus fréquent des rhumatismes inflammatoires chroniques. Sa prévalence en population générale est de l’ordre de 0,3 à 0,8 % chez l’adulte.
La polyarthrite rhumatoïde (PR) est le plus fréquent des rhumatismes inflammatoires chroniques. Sa prévalence en population générale est de l’ordre de 0,3 à 0,8 % chez l’adulte.
Elle débute habituellement autour de 50 ans, mais elle peut survenir à tout âge, avec des formes juvéniles avant 16 ans et des formes à début tardif après 65 ans.La PR est trois fois plus fréquente chez la femme avant 60 ans, mais ce déséquilibre du sex-ratio s’atténue progressivement au-delà de cet âge.
![]() Sa prévalence chez les apparentés du premier degré d’un patient atteint de PR est de l’ordre de 2 à 4 %, ce qui signifie en pratique que, malgré le surrisque de nature génétique et environnementale conféré par l’existence d’un antécédent familial, plus de 95 % des apparentés du premier degré d’un patient atteint de PR seront indemnes de la maladie.
Sa prévalence chez les apparentés du premier degré d’un patient atteint de PR est de l’ordre de 2 à 4 %, ce qui signifie en pratique que, malgré le surrisque de nature génétique et environnementale conféré par l’existence d’un antécédent familial, plus de 95 % des apparentés du premier degré d’un patient atteint de PR seront indemnes de la maladie.
![]() La PR est une maladie multifactorielle, de cause inconnue, impliquant :
La PR est une maladie multifactorielle, de cause inconnue, impliquant :
Ces facteurs contribuent à une réponse immunitaire innée et adaptative incontrôlée initialement dans les muqueuses (poumon, bouche, intestin…), avec une rupture de tolérance, se traduisant par la production d’autoanticorps au premier rang desquels le facteur rhumatoïde (FR) et les autoanticorps anti-protéines citrullinées (ACPA). La réponse immunitaire deviendra ensuite systémique puis articulaire, avec l’apparition d’une réaction inflammatoire de la membrane synoviale, dénommée synovite.
À terme, cette synovite pourra être à l’origine des destructions articulaires, associant des érosions osseuses et un pincement de l’interligne articulaire signant la chondrolyse et faisant la gravité de la maladie. La figure 17.1 synthétise les principaux acteurs de la physiopathologie de la PR.
Fig. 17.1. ![]() Physiopathologie de la polyarthrite rhumatoïde : de la rupture de tolérance à la phase d’état.
Physiopathologie de la polyarthrite rhumatoïde : de la rupture de tolérance à la phase d’état.
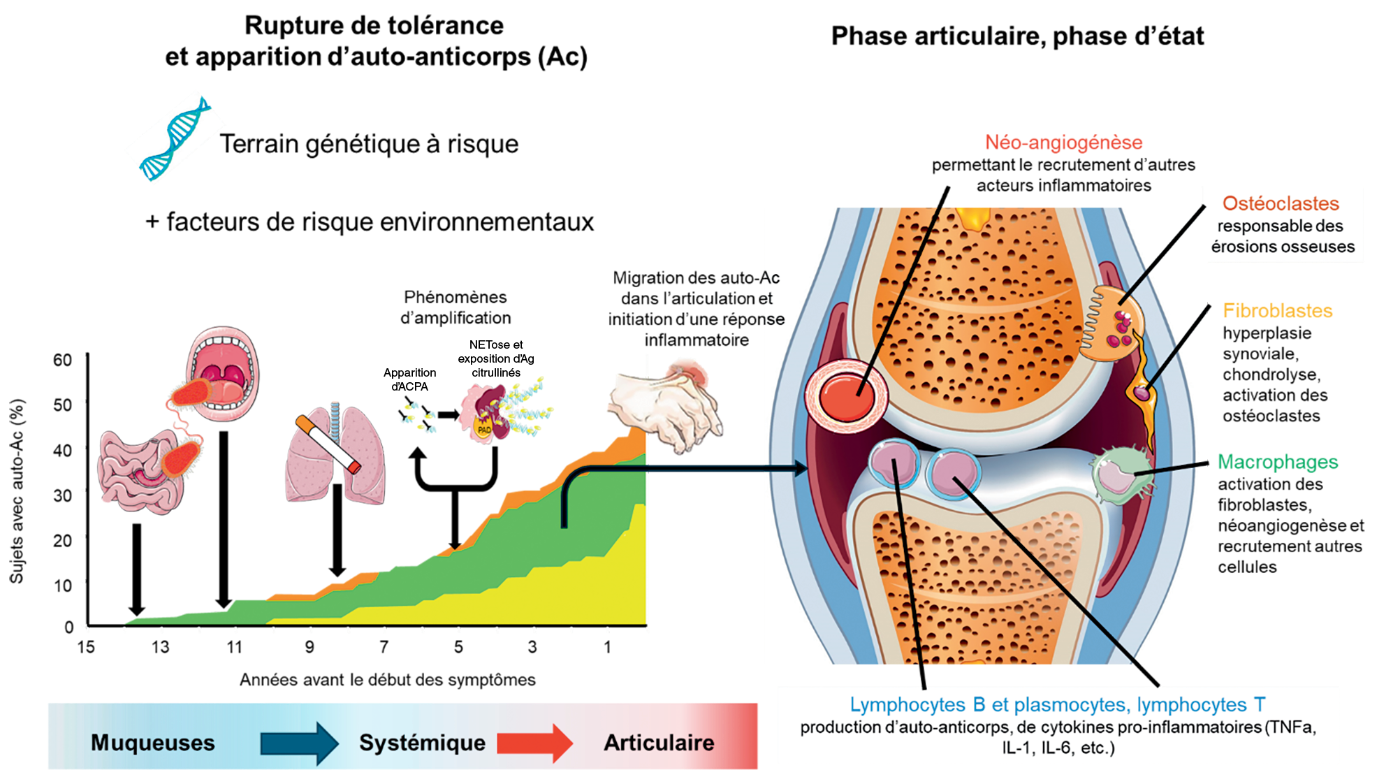
![]() Le rôle central des cellules de l’immunité (lymphocytes T et B) et des cytokines pro-inflammatoires dans la pathogénie de la PR a fait de ces cellules et de ces médiateurs intercellulaires des cibles thérapeutiques de choix avec l’arrivée des thérapies ciblées dans les années 2000 : biomédicaments ciblant spécifiquement les cytokines pro-inflammatoires (anti-TNF) ou leurs récepteurs (anti-IL-6R), les lymphocytes B (antiCD20) ou les voies de costimulation des lymphocytes T (CTLA4-Ig) ou petites molécules ciblant spécifiquement les voies de signalisation intracellulaire des récepteurs des cytokines de la réponse immunitaire ou de la réaction inflammatoire (inhibiteurs des Janus kinases, ou JAKi).
Le rôle central des cellules de l’immunité (lymphocytes T et B) et des cytokines pro-inflammatoires dans la pathogénie de la PR a fait de ces cellules et de ces médiateurs intercellulaires des cibles thérapeutiques de choix avec l’arrivée des thérapies ciblées dans les années 2000 : biomédicaments ciblant spécifiquement les cytokines pro-inflammatoires (anti-TNF) ou leurs récepteurs (anti-IL-6R), les lymphocytes B (antiCD20) ou les voies de costimulation des lymphocytes T (CTLA4-Ig) ou petites molécules ciblant spécifiquement les voies de signalisation intracellulaire des récepteurs des cytokines de la réponse immunitaire ou de la réaction inflammatoire (inhibiteurs des Janus kinases, ou JAKi).
![]() Le diagnostic de PR débutante repose sur les données issues de l’examen clinique et d’examens biologiques et radiographiques, complétés par un examen échographique en cas de doute sur l’existence d’une ou plusieurs synovites. Le diagnostic de PR nécessite la présence d’au moins une articulation gonflée (synovite clinique).
Le diagnostic de PR débutante repose sur les données issues de l’examen clinique et d’examens biologiques et radiographiques, complétés par un examen échographique en cas de doute sur l’existence d’une ou plusieurs synovites. Le diagnostic de PR nécessite la présence d’au moins une articulation gonflée (synovite clinique).
Le diagnostic de PR doit être aussi précoce que possible, afin d’initier, dès la confirmation diagnostique par le rhumatologue, un traitement de fond visant à obtenir et à maintenir un état de rémission ou, à défaut, de faible niveau d’activité de la maladie, permettant de prévenir les signes radiographiques, le handicap fonctionnel et les complications systémiques de l’inflammation, tout en préservant la qualité de vie et les capacités socioprofessionnelles du patient.
Les signes cliniques classiques d’une PR débutante sont résumés dans le tableau 17.1.
Tableau 17.1. ![]() Résumé des principaux éléments du diagnostic positif d’une polyarthrite rhumatoïde débutante.
Résumé des principaux éléments du diagnostic positif d’une polyarthrite rhumatoïde débutante.
| Diagnostic positif d’une polyarthrite rhumatoïde débutante | |
|---|---|
| Signes cliniques classiques (70–80 %) |
– Douleurs articulaires inflammatoires (réveils spontanés en seconde partie de nuit et raideur matinale > 30 minutes) – Gonflements articulaires souvent responsables d’une limitation de la mobilité articulaire (fig. 17.2) – Ténosynovites : tendons extenseurs des doigts, de l’extenseur ulnaire du carpe, fléchisseurs des doigts (pouvant occasionner un syndrome du canal carpien) et fibulaires – Atteinte préférentielle des poignets, articulations métacarpophalangiennes, interphalangiennes des doigts et articulations métatarsophalangiennes – Les articulations interphalangiennes distales sont habituellement respectées au cours de la PR, contrairement à ce qui est observé dans le rhumatisme psoriasique, la goutte ou l’arthrose – Topographie bilatérale et globalement symétrique – Évolution généralement > 6 semaines (le diagnostic de PR peut cependant être posé dès que possible sans attendre 6 semaines) |
| Signes biologiques | – Élévation inconstante de la vitesse de sédimentation globulaire – Élévation inconstante de la protéine C-réactive – Positivité inconstante de la recherche du facteur rhumatoïde – Positivité inconstante de la recherche des autoanticorps anti-protéines citrullinées (ACPA) – Liquide synovial inflammatoire |
| Signes d’imagerie | – Sur les radiographies standards : • Elles sont le plus souvent normales dans la PR débutante et servent d’examen de référence • De façon précoce : lésions structurales à type d’érosions osseuses ou de pincements des interlignes articulaires, notamment sur : – les carpes – les articulations métacarpophalangiennes – les articulations interphalangiennes proximales des doigts – les articulations métatarsophalangiennes, en particulier en regard des têtes des cinquièmes métatarsiens (fig. 17.3) |
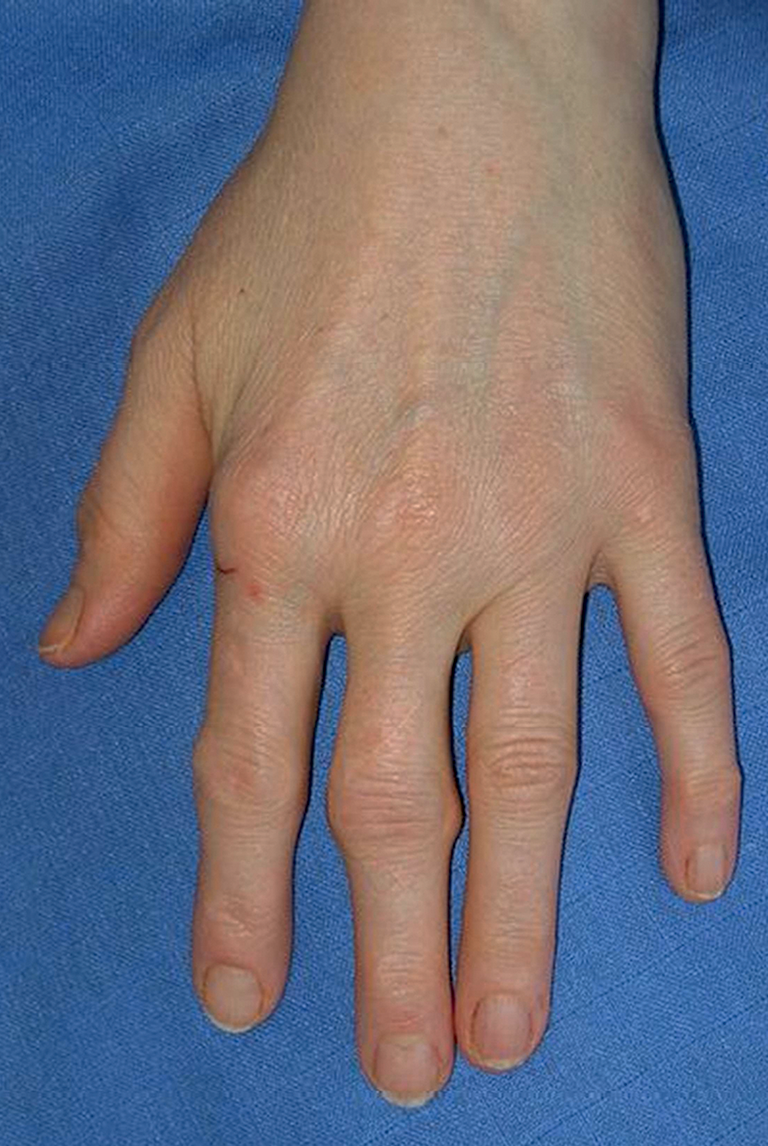
Fig. 17.2. ![]() Gonflements des articulations métacarpophalangiennes et des articulations interphalangiennes proximales de l’index et du majeur (aspect en « fuseau ») dans le cadre d’une polyarthrite débutante.
Gonflements des articulations métacarpophalangiennes et des articulations interphalangiennes proximales de l’index et du majeur (aspect en « fuseau ») dans le cadre d’une polyarthrite débutante.
![]() D’autres formes cliniques sont possibles dans 20 à 30 % des cas :
D’autres formes cliniques sont possibles dans 20 à 30 % des cas :
![]() Il existe une élévation de la CRP (et de la vitesse de sédimentation si elle est réalisée) chez la majorité des patients, cependant la présence d’un syndrome inflammatoire biologique n’est pas spécifique de la PR et son absence n’élimine pas le diagnostic.
Il existe une élévation de la CRP (et de la vitesse de sédimentation si elle est réalisée) chez la majorité des patients, cependant la présence d’un syndrome inflammatoire biologique n’est pas spécifique de la PR et son absence n’élimine pas le diagnostic.
L’hémogramme peut montrer une hyperleucocytose à polynucléaires neutrophiles, une thrombocytose ou une anémie inflammatoire légère à modérée, s’intégrant dans le cadre de l’inflammation chronique.
Le FR est une immunoglobuline le plus souvent de classe IgM, ayant une activité anticorps dirigée contre des immunoglobulines animales ou humaines de classe IgG.
La positivité du FR n’est pas spécifique de la PR et son absence n’élimine pas le diagnostic (tableau 17.2).
La positivité du FR peut être observée :
![]() La détection des facteurs rhumatoïdes se fait par néphélométrie laser ou test ELISA, avec des résultats quantifiés en unités internationales et un seuil de positivité établi et validé en fonction du test utilisé.
La détection des facteurs rhumatoïdes se fait par néphélométrie laser ou test ELISA, avec des résultats quantifiés en unités internationales et un seuil de positivité établi et validé en fonction du test utilisé.
Tableau 17.2. ![]()
![]() Sensibilité et spécificité des anticorps utilisés pour le diagnostic de PR.
Sensibilité et spécificité des anticorps utilisés pour le diagnostic de PR.
| Facteur rhumatoïde (FR) | Autoanticorps anti-protéines citrullinées (ACPA) | |
|---|---|---|
| Sensibilité dans la PR | 60–80 % | 60–75 % |
| Spécificité dans la PR | 65–85 % | 90–95 % |
| Prévalence dans d’autres pathologies | ||
| Maladie de Gougerot-Sjögren | 50–80 % | 10 % |
| Rhumatisme psoriasique | 10 % | 10 % |
| Lupus systémique | 20–30 % | 10 % |
| Sclérodermie systémique | 10–20 % | 10 % |
| Cryoglobulinémie mixte | > 90 % | |
![]() Les ACPA sont dirigés contre des protéines dont des résidus d’arginine ont été transformés en citrulline sous l’action de peptidylarginine déiminase.
Les ACPA sont dirigés contre des protéines dont des résidus d’arginine ont été transformés en citrulline sous l’action de peptidylarginine déiminase.
La positivité des ACPA n’est pas spécifique de la PR et leur absence n’élimine pas le diagnostic (tableau 17.2).
![]() Les ACPA sont actuellement détectés avec des tests ELISA, utilisant notamment des peptides cycliques citrullinés comme substrat, commercialisés sous le nom de test antiCCP de première, deuxième ou troisième génération (anti-CCP1, 2 ou 3), avec des résultats quantifiés en unités internationales et un seuil de positivité établi et validé en fonction du test utilisé.
Les ACPA sont actuellement détectés avec des tests ELISA, utilisant notamment des peptides cycliques citrullinés comme substrat, commercialisés sous le nom de test antiCCP de première, deuxième ou troisième génération (anti-CCP1, 2 ou 3), avec des résultats quantifiés en unités internationales et un seuil de positivité établi et validé en fonction du test utilisé.
![]() Le FR et les ACPA sont habituellement présents dès les premiers signes cliniques de la maladie puisqu’il peut précéder l’apparition des signes cliniques de plusieurs mois à plusieurs années. Le FR ne se positive au cours des premières années d’évolution de la PR que chez une faible proportion de patients ( 10 %) chez qui il était initialement négatif. En cas de positivité initiale, il n’est pas utile de répéter la recherche. En cas de négativité initiale, il peut être utile de répéter la recherche une fois au cours des premières années d’évolution de la maladie.
Le FR et les ACPA sont habituellement présents dès les premiers signes cliniques de la maladie puisqu’il peut précéder l’apparition des signes cliniques de plusieurs mois à plusieurs années. Le FR ne se positive au cours des premières années d’évolution de la PR que chez une faible proportion de patients ( 10 %) chez qui il était initialement négatif. En cas de positivité initiale, il n’est pas utile de répéter la recherche. En cas de négativité initiale, il peut être utile de répéter la recherche une fois au cours des premières années d’évolution de la maladie.
Lors de la démarche diagnostique, la ponction articulaire d’une moyenne ou d’une grosse articulation est réalisée chaque fois que possible. Elle permet une analyse cytologique, bactériologique et une recherche de cristaux.
Au cours de la PR, le liquide synovial est :
Les radiographies standards à demander systématiquement dans le cadre d’une PR débutante sont :
Elles peuvent montrer de façon précoce des lésions structurales à type d’érosions osseuses ou des pincements des interlignes articulaires.
Les articulations les plus atteintes sont les carpes, les articulations métacarpophalangiennes, les articulations interphalangiennes proximales des doigts et les articulations métatarsophalangiennes, en particulier les cinquièmes têtes métatarsiennes (fig. 17.3).
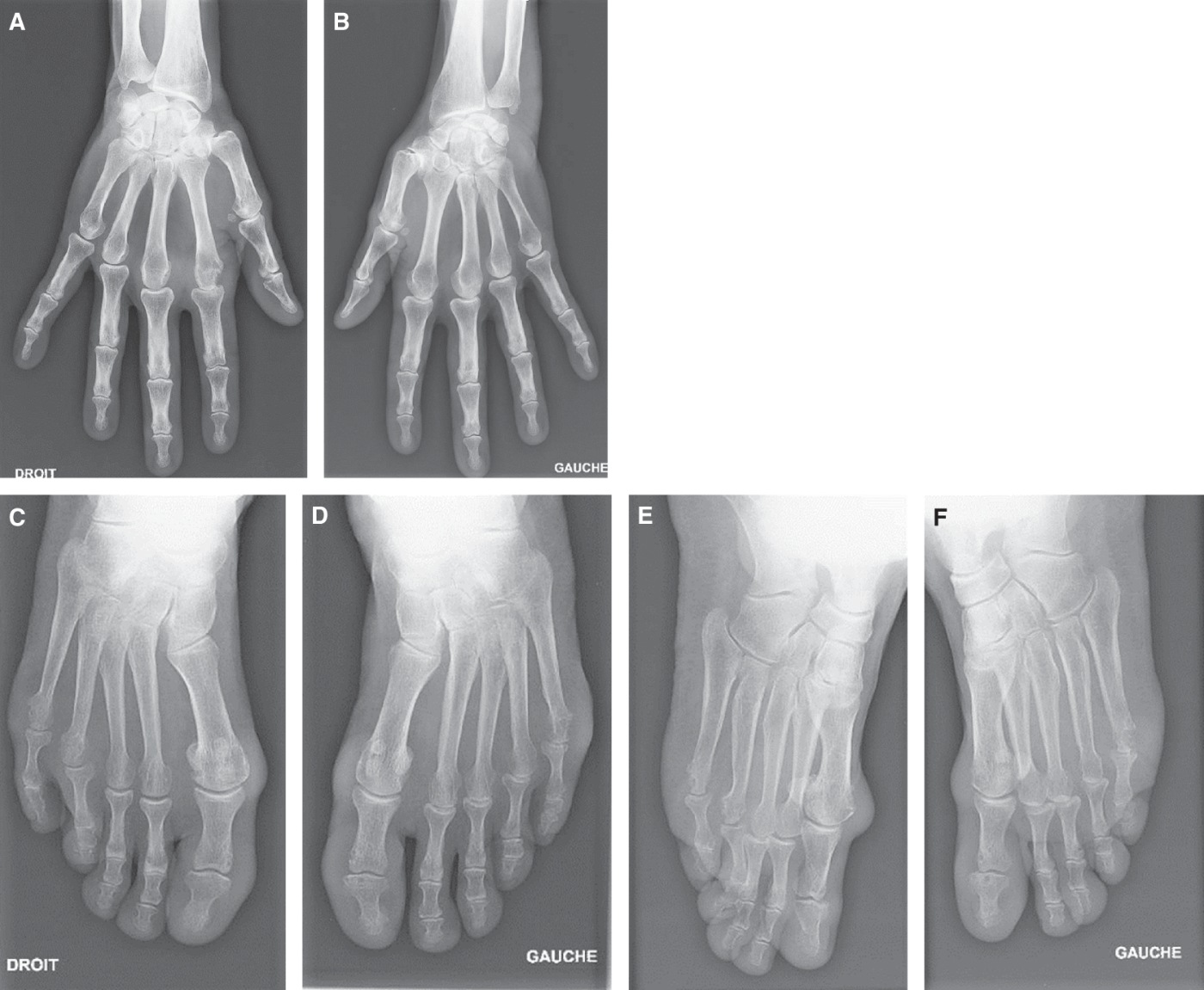
Fig. 17.3. ![]() Polyarthrite rhumatoïde : érosions osseuses et pincements.
Polyarthrite rhumatoïde : érosions osseuses et pincements.
Radiographie des mains de face : érosion de la MCP2 droite (A) et pincement des MCP2 et MCP3 bilatéral (A, B). Radiographie des pieds de face (C, D) et trois quarts (E, F) : érosion des 5es têtes métacarpiennes et de la 4e droite.
Une radiographie thoracique sera également réalisée (afin d’éliminer un diagnostic différentiel et avant de débuter le méthotrexate).
![]() Dans le cadre d’une PR débutante, il est utile de répéter les radiographies des mains, des pieds et des autres articulations inflammatoires tous les 6 mois au cours de la première année puis tous ans au cours des 3 premières années. La périodicité des contrôles est ensuite adaptée en tenant compte de l’existence ou de la progression des lésions structurales, de l’atteinte de l’objectif thérapeutique et du traitement de fond utilisé. Chez la grande majorité des patients atteignant l’objectif thérapeutique, particulièrement en cas de thérapie ciblée, il n’y aura pas de progression des lésions structurales.
Dans le cadre d’une PR débutante, il est utile de répéter les radiographies des mains, des pieds et des autres articulations inflammatoires tous les 6 mois au cours de la première année puis tous ans au cours des 3 premières années. La périodicité des contrôles est ensuite adaptée en tenant compte de l’existence ou de la progression des lésions structurales, de l’atteinte de l’objectif thérapeutique et du traitement de fond utilisé. Chez la grande majorité des patients atteignant l’objectif thérapeutique, particulièrement en cas de thérapie ciblée, il n’y aura pas de progression des lésions structurales.
![]() Une échographie articulaire (fig. 17.4) peut être réalisée en cas de doute sur la présence d’une synovite ou d’une ténosynovite ou pour évaluer l’activité de la maladie. Elle permet de visualiser :
Une échographie articulaire (fig. 17.4) peut être réalisée en cas de doute sur la présence d’une synovite ou d’une ténosynovite ou pour évaluer l’activité de la maladie. Elle permet de visualiser :
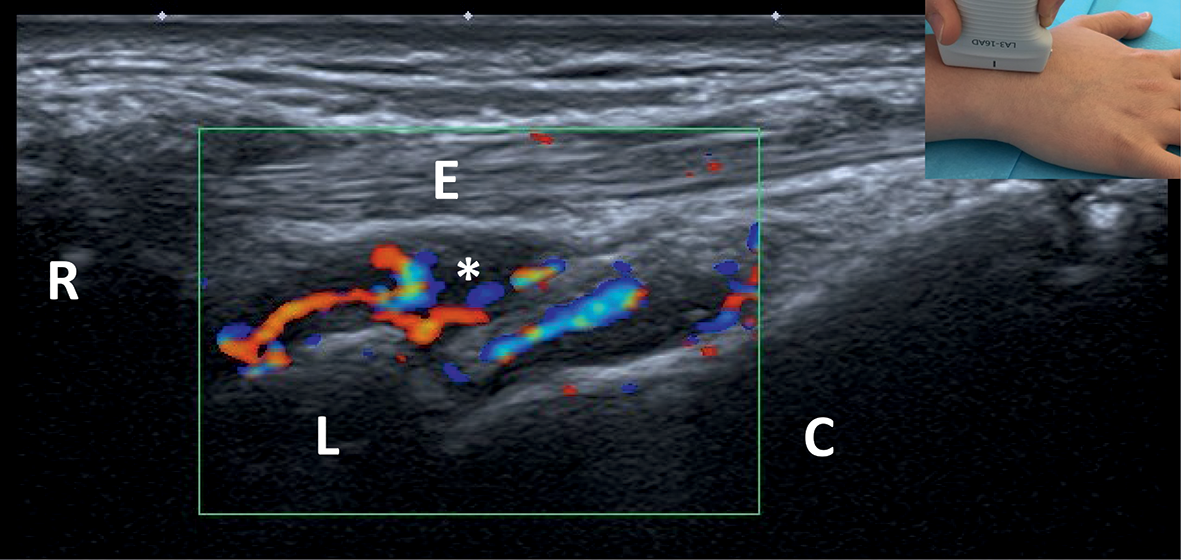
Fig. 17.4. ![]() Échographie-doppler de la face dorsale du poignet.
Échographie-doppler de la face dorsale du poignet.
On voit sur cette image une synovite hypoéchogène (*), avec positivité du doppler traduisant l’existence d’une hypervascularisation de la membrane synoviale.
R : radius ; L : lunatum ; C : capitatum ; E : tendons du muscle extenseur des doigts.
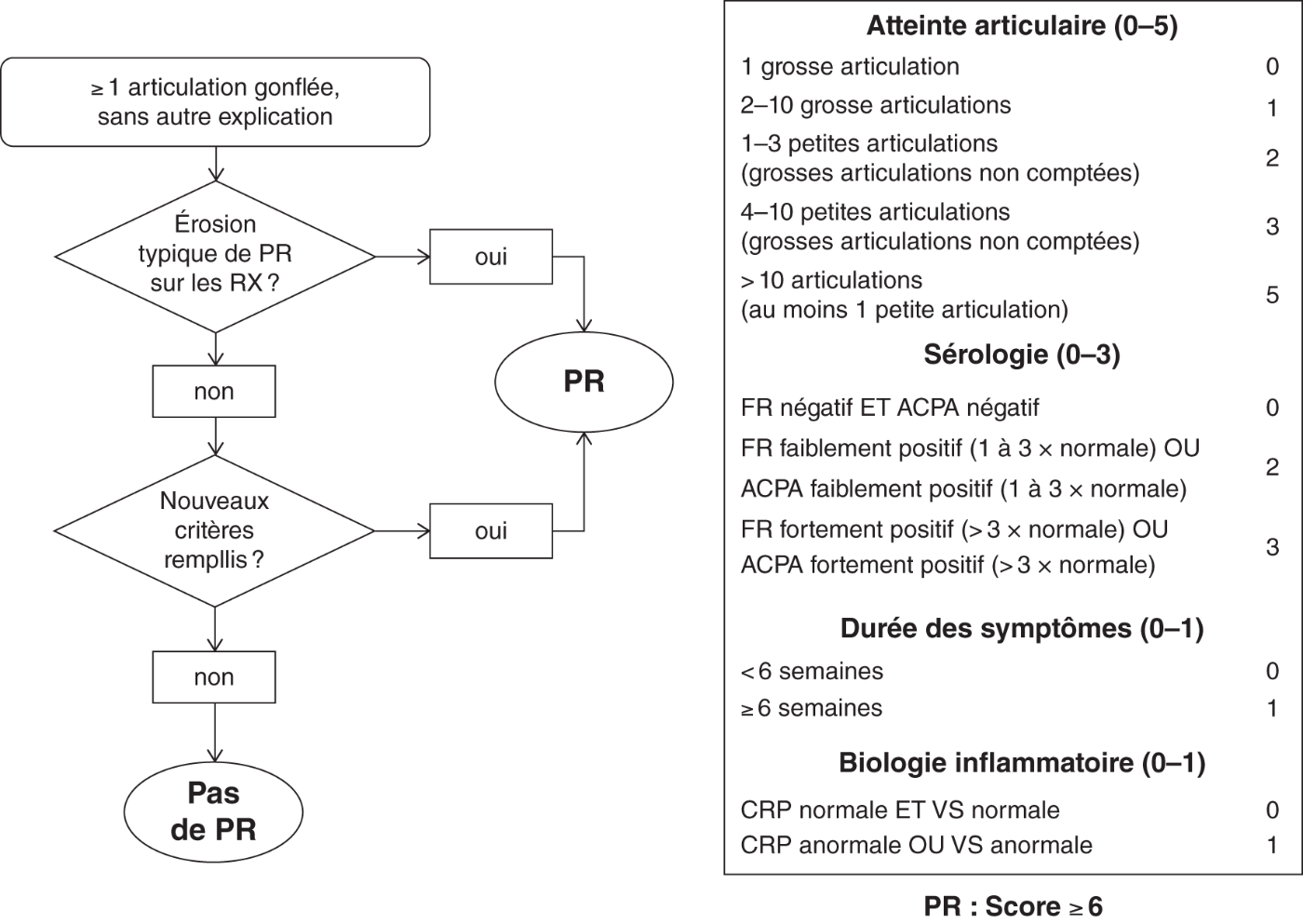
![]() Des critères de classification de la PR (fig. 17.5) ont été établis en 2010 de façon collégiale par des rhumatologues européens et américains à partir de cohortes de patients et de cas patients atteints d’arthrites débutantes. Ils peuvent aider le clinicien pour le diagnostic de PR débutante et rappellent la démarche diagnostique qui commence par la présence d’un gonflement articulaire clinique et l’absence de diagnostic différentiel. On notera qu’une durée d’évolution supérieure à 6 semaines rajoute un point supplémentaire mais n’est pas indispensable au diagnostic.
Des critères de classification de la PR (fig. 17.5) ont été établis en 2010 de façon collégiale par des rhumatologues européens et américains à partir de cohortes de patients et de cas patients atteints d’arthrites débutantes. Ils peuvent aider le clinicien pour le diagnostic de PR débutante et rappellent la démarche diagnostique qui commence par la présence d’un gonflement articulaire clinique et l’absence de diagnostic différentiel. On notera qu’une durée d’évolution supérieure à 6 semaines rajoute un point supplémentaire mais n’est pas indispensable au diagnostic.
Fig. 17.5. ![]() Critères de classification 2010 de la polyarthrite rhumatoïde (PR) selon les Collèges européen et américain de rhumatologie.
Critères de classification 2010 de la polyarthrite rhumatoïde (PR) selon les Collèges européen et américain de rhumatologie.
Source : Gaujoux-Viala C, Gossec L, Cantagrel A, et al. Recommandations de la Société française de rhumatologie pour la prise en charge de la polyarthrite rhumatoïde. Rev Rhum 2014;81:303–12.
![]() Le recueil systématique des paramètres d’évaluation dans le suivi permet une quantification initiale et un suivi standardisé de l’évolution de l’activité de la maladie, reposant sur un score validé d’activité de la maladie dénommé DAS28 (Disease Activity Score).
Le recueil systématique des paramètres d’évaluation dans le suivi permet une quantification initiale et un suivi standardisé de l’évolution de l’activité de la maladie, reposant sur un score validé d’activité de la maladie dénommé DAS28 (Disease Activity Score).
Les articulations incluses dans ce score sont : 2 épaules, 2 coudes, 2 poignets, 10 métacarpophalangiennes, 10 interphalangiennes proximales des doigts et 2 genoux.
Encadré 17.1. Paramètres d’évaluation de l’activité de la PR pris en compte pour le calcul du DAS28
D’après : Daien C, Hua C, Gaujoux-Viala C, et al. Actualisation des Recommandations de la Société française de rhumatologie pour la prise en charge de la polyarthrite rhumatoïde. Rev Rhum 2019;86:8–24.
Attention, d’autres paramètres sont également à évaluer en dehors de ce score :
Au sein du faisceau d’arguments cliniques, biologiques et d’imagerie permettant au rhumatologue d’établir le diagnostic de PR, la présence et la précocité d’un ou plusieurs des éléments suivants constituent des facteurs pronostiques de sévérité structurale, fonctionnelle et/ou globale.
Encadré 17.2. Facteurs pronostiques de sévérité structurale, fonctionnelle et/ou globale d’une polyarthrite rhumatoïde
HAQ : Health Assessment Questionnaire, questionnaire d’incapacité fonctionnelle spécifique de la PR, portant sur huit domaines d’activité de la vie quotidienne, coté de 0 à 3, un score de 0 correspondant à l’absence d’incapacité et un score de 3 correspondant à une incapacité maximale.
Les critères de classification de la PR soulignent la nécessité de s’assurer que les gonflements articulaires ne sont pas expliqués par une autre maladie.
L’interrogatoire et l’examen physique sont essentiels pour rechercher des manifestations extra-articulaires pouvant orienter vers ces diverses affections, pouvant être révélées par des arthrites périphériques.
Il convient notamment d’écarter les arthropathies infectieuses (item 156), les arthrites microcristallines (item 198), le rhumatisme psoriasique (item 117) et les autres formes péri-
phériques de spondyloarthrites (item 197), les connectivites dont la maladie de GougerotSjögren (item 192), le lupus systémique (item 194) et la sclérodermie systémique, ainsi que certaines vascularites (item 193), granulomatoses et maladies auto-inflammatoires à expression articulaire.
Un certain nombre d’examens complémentaires sont utiles dans le cadre du diagnostic différentiel :
![]() La précocité du diagnostic et de l’initiation d’un traitement de fond synthétique conventionnel (csDMARD) puis, si nécessaire, d’un traitement de fond ciblé, visant à obtenir et à maintenir un état de rémission ou, à défaut, de faible niveau d’activité de la maladie, ont non seulement pour objectifs de prévenir les manifestations ostéoarticulaires de la phase d’état, mais aussi de diminuer l’incidence et la sévérité des manifestations extraarticulaires ou systémiques et de préserver l’espérance de vie des patients, habituellement menacée par les comorbidités cardiovasculaires, infectieuses ou tumorales.
La précocité du diagnostic et de l’initiation d’un traitement de fond synthétique conventionnel (csDMARD) puis, si nécessaire, d’un traitement de fond ciblé, visant à obtenir et à maintenir un état de rémission ou, à défaut, de faible niveau d’activité de la maladie, ont non seulement pour objectifs de prévenir les manifestations ostéoarticulaires de la phase d’état, mais aussi de diminuer l’incidence et la sévérité des manifestations extraarticulaires ou systémiques et de préserver l’espérance de vie des patients, habituellement menacée par les comorbidités cardiovasculaires, infectieuses ou tumorales.
Actuellement, les tableaux décrits ci-dessous ne devraient donc plus se voir chez un patient débutant une PR.
Les gonflements articulaires, initialement réversibles, traduisant la présence d’une synovite et/ou d’un épanchement liquidien intra-articulaire, peuvent évoluer, en l’absence de prise en charge thérapeutique efficace, vers des déformations ostéoarticulaires irréversibles, traduisant les lésions des structures capsuloligamentaires et ostéocartilagineuses. Ces déformations sont plus rares à l’heure actuelle grâce aux avancées thérapeutiques de ces dernières années.
L’ensemble des articulations périphériques peuvent être touchées, ainsi que le rachis cervical au niveau C1-C2, la PR respectant le rachis thoraco-lombaire et les sacroiliaques.
L’atteinte des mains est la plus fréquente et la plus précoce.
Parmi les déformations caractéristiques des doigts, on citera notamment :
Fig. 17.6. ![]() Polyarthrite rhumatoïde établie avec atteinte des doigts.
Polyarthrite rhumatoïde établie avec atteinte des doigts.
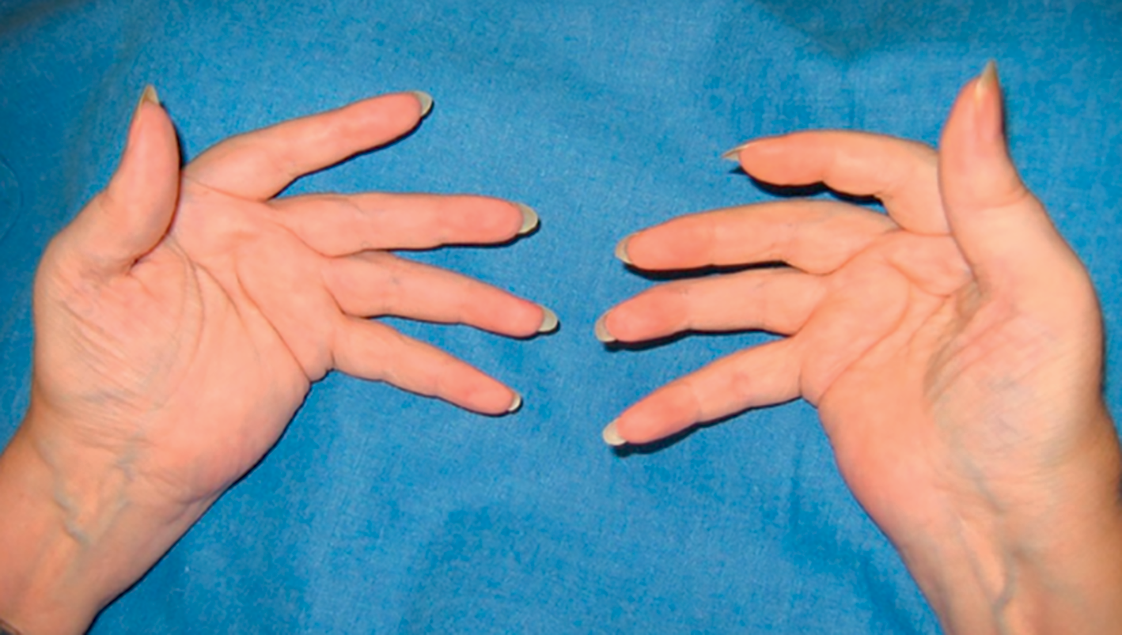
Déformations élémentaires ; « coup de vent » ulnaire des doigts (secondaire à une déviation radiale du poignet et à un subluxation-dislocation des MCP).
Parmi les déformations caractéristiques de l’avant-pied, on citera notamment un avantpied triangulaire, combinant hallux valgus, « coup de vent » fibulaire des orteils et quintus varus (fig. 17.7).
Ces déformations ostéoarticulaires et ces lésions cutanées se compliquent fréquemment d’ulcérations cutanées, constituant des portes d’entrée infectieuses potentielles (fig. 17.7).
Fig. 17.7. ![]() Polyarthrite rhumatoïde établie avec atteinte de l’avant-pied.
Polyarthrite rhumatoïde établie avec atteinte de l’avant-pied.
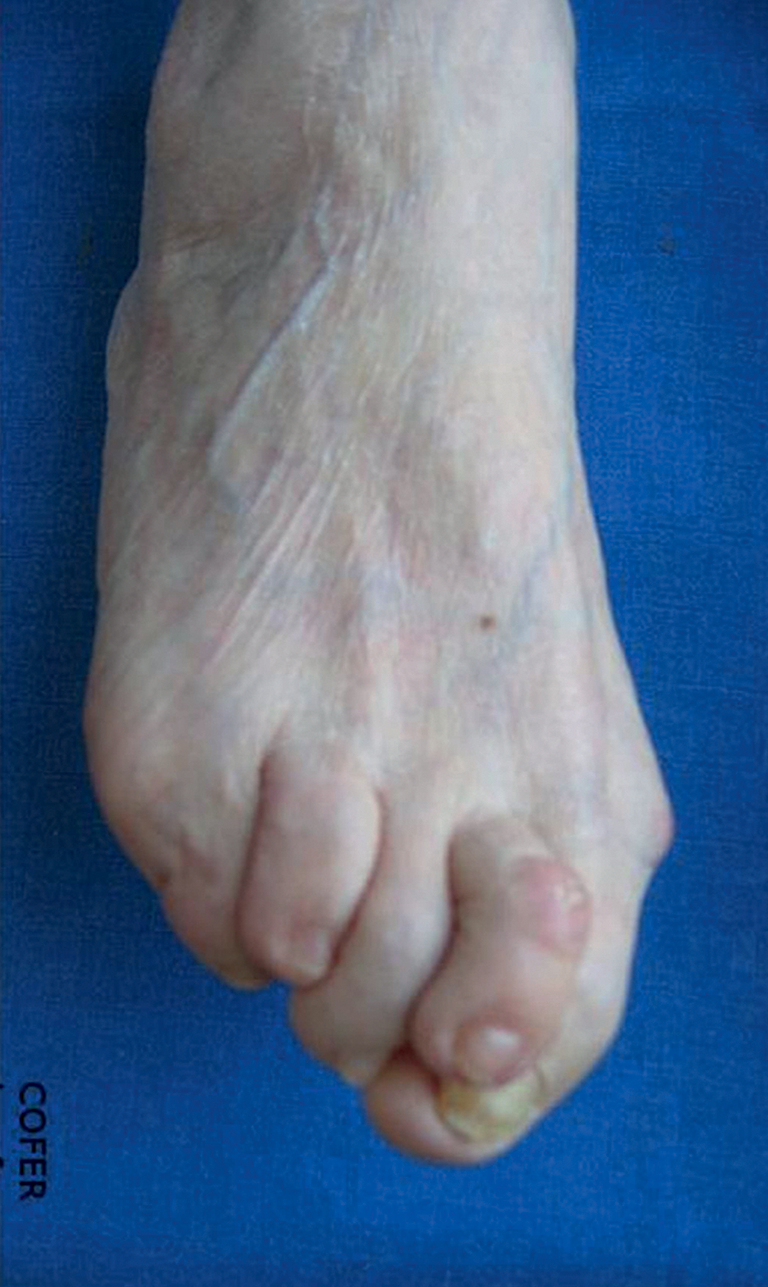
Avant-pied triangulaire combinant un hallux valgus, un « coup de vent » fibulaire des orteils et un quintus varus, avec une hyperextension de la première phalange, des signes d’hyperkératose et une ulcération de la face dorsale de l’articulation interphalangienne du deuxième orteil.
Les manifestations extra-articulaires de la PR traduisent le caractère systémique de la maladie. Elles sont inconstantes, constituant un facteur pronostique de sévérité de la maladie et pouvant parfois menacer le pronostic vital.
Le tableau 17.3 résume les principales atteintes extra-articulaires et comorbidités que l’on peut retrouver à la phase d’état.
Tableau 17.3.![]()
![]() Atteintes extra-articulaires et comorbidités de la polyarthrite rhumatoïde en phase d’état.
Atteintes extra-articulaires et comorbidités de la polyarthrite rhumatoïde en phase d’état.
| Domaine | Atteintes principales |
|---|---|
| Manifestations extra-articulaires | |
| Signes généraux | Fébrile Asthénie Trouble du sommeil Adénopathies superficielles Syndrome sec |
| Nodules rhumatoïdes | Sous-cutanés, pleuropulmonaires… |
| Atteintes pleuropulmonaires | Pneumopathies interstitielles diffuses des nodules rhumatoïdes Pleurésies rhumatoïdes Bronchiolites Pneumopathies organisées |
| Autres (rares à très rares) | Cardiovasculaires : péricardites, myocardites Cutané : vascularite rhumatoïde Ophtalmologique : sclérite, épisclérite, scléromalacie perforante Hématologique : syndrome de Felty, leucémie à grands lymphocytes granuleux |
| Comorbidités | |
| Cardiovasculaires | Infarctus du myocarde, accidents vasculaires cérébraux |
| Cancers | Sur risque de lymphome (PR active et sévère) et de cancers pulmonaires (tabagisme) |
| Infections | Liées à la maladie mais aussi iatrogène (corticothérapie et traitements de fond) |
| Osseuses | Ostéoporose, liée à l’inflammation systémique mais aussi iatrogène (corticothérapie) |
Signes généraux
Nodules rhumatoïdes
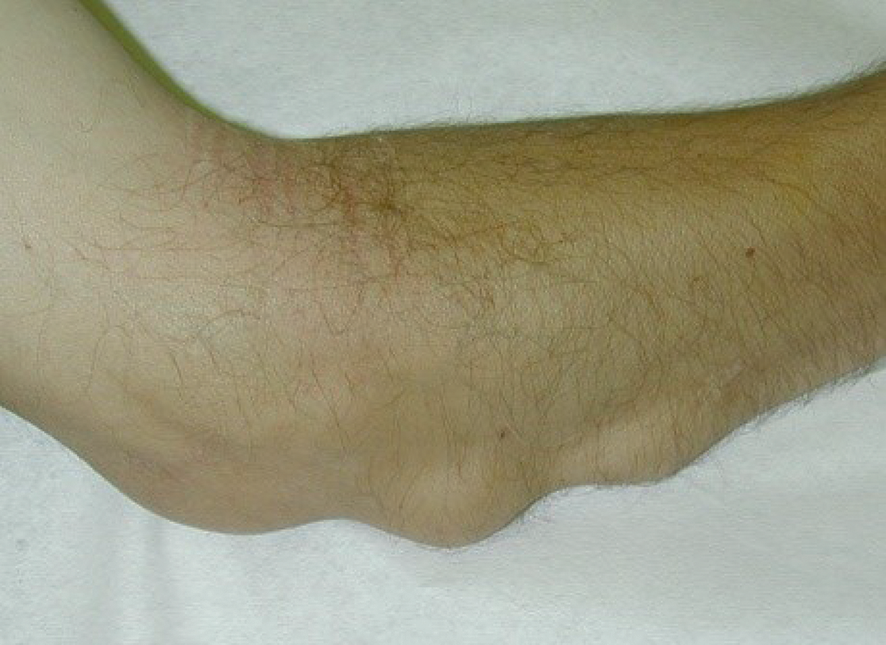
Les nodules rhumatoïdes concernent 10 à 20 % des patients, apparaissant souvent après quelques années d’évolution de la maladie, le plus souvent chez des PR avec positivité du FR et/ou des ACPA.
Il s’agit de nodules sous-cutanés, fermes, indolores, le plus souvent mobiles, parfois fixes, siégeant souvent sur la face d’extension des membres : dans la région olécrânienne, parfois au sein d’une bursite rétro-olécrânienne, à la face postérieure de l’avantbras en regard de la crête ulnaire, à la face dorsale et plus rarement palmaire des doigts, en regard du tendon calcanéen ou aux pieds (fig. 17.8).![]() Des localisations viscérales sont possibles, essentiellement pleuropulmonaires, exceptionnellement sur d’autres sites (œil, larynx, valve cardiaque…). Ces nodules évoluent habituellement indépendamment de l’activité de la PR, pouvant grossir, s’ulcérer ou régresser spontanément, parfois améliorés ou au contraire majorés par certains traitements de fond, tels que le méthotrexate.
Des localisations viscérales sont possibles, essentiellement pleuropulmonaires, exceptionnellement sur d’autres sites (œil, larynx, valve cardiaque…). Ces nodules évoluent habituellement indépendamment de l’activité de la PR, pouvant grossir, s’ulcérer ou régresser spontanément, parfois améliorés ou au contraire majorés par certains traitements de fond, tels que le méthotrexate.
Histologiquement, les nodules rhumatoïdes sont des lésions hypodermiques profondes, constituées d’une nécrose fibrinoïde collagénique éosinophile, avec un infiltrat histiocytaire palissadique souvent associé à des cellules géantes, bordé d’une zone de fibrose accompagnée d’une hypervascularisation et d’un infiltrat cellulaire polymorphe.
Fig. 17.8. ![]() Nodules rhumatoïdes en regard de la crête ulnaire illustrant une des manifestations extra-articulaires de la PR à la phase d’état.
Nodules rhumatoïdes en regard de la crête ulnaire illustrant une des manifestations extra-articulaires de la PR à la phase d’état.
![]() L’incidence des manifestations pleuropulmonaires de la PR est sous-estimée car elles sont souvent asymptomatiques, mal visualisées par le cliché thoracique systématiquement réalisé au début de la maladie, révélant des anomalies dans moins de 10 % des cas, bien visualisées par la réalisation d’un scanner thoracique haute résolution chez les patients symptomatiques (toux, dyspnée, anomalies auscultatoires) montrant des anomalies dans 20 à 50 % des cas.
L’incidence des manifestations pleuropulmonaires de la PR est sous-estimée car elles sont souvent asymptomatiques, mal visualisées par le cliché thoracique systématiquement réalisé au début de la maladie, révélant des anomalies dans moins de 10 % des cas, bien visualisées par la réalisation d’un scanner thoracique haute résolution chez les patients symptomatiques (toux, dyspnée, anomalies auscultatoires) montrant des anomalies dans 20 à 50 % des cas.
Ces manifestations pleuropulmonaires comportent :
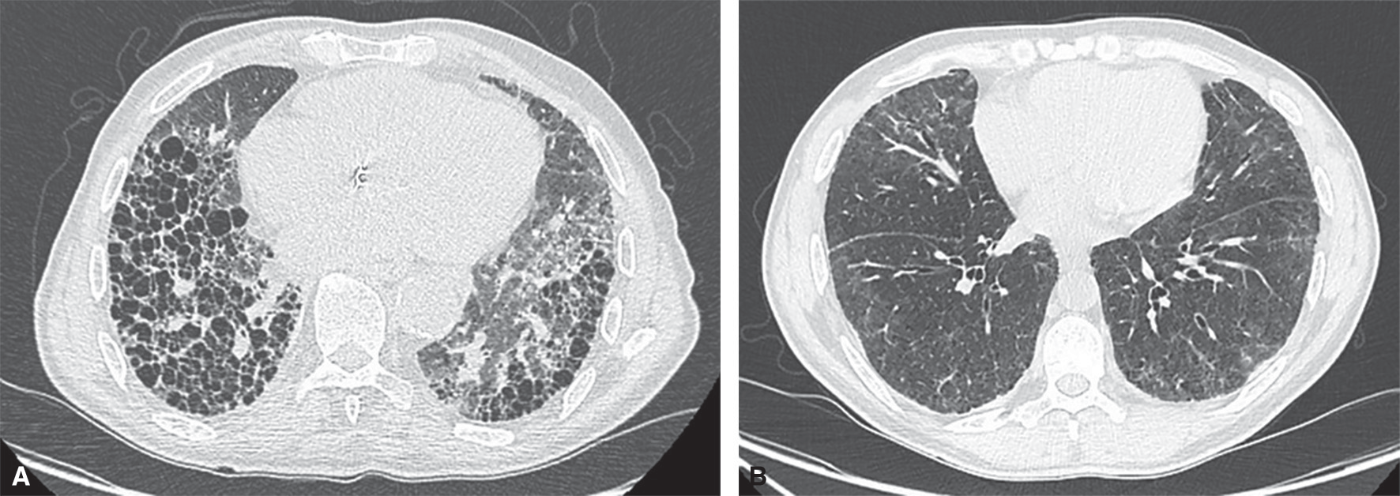
Les pneumopathies interstitielles diffuses constituent la manifestation pleuropulmonaire la plus fréquente, notamment chez les hommes, tabagiques, avec une PR nodulaire et une forte positivité du FR et surtout des ACPA. Les pneumopathies interstitielles non spécifiques et les pneumopathies interstitielles communes en sont les deux principaux types (fig. 17.9). Elles restent longtemps asymptomatiques. Elles sont potentiellement sévères, associées à la surmortalité, à la diminution de l’espérance de vie de la PR. Il est donc nécessaire, lors du suivi d’un patient atteint de PR, de rechercher des symptômes évocateurs d’une atteinte pulmonaire, qui justifieraient la réalisation d’un scanner thoracique haute résolution.
![]() On citera pour mémoire le syndrome de Caplan-Colinet, caractérisé par l’association d’une PR et d’une pneumoconiose, en relation avec l’exposition à la poussière de silice.
On citera pour mémoire le syndrome de Caplan-Colinet, caractérisé par l’association d’une PR et d’une pneumoconiose, en relation avec l’exposition à la poussière de silice.
Fig. 17.9. ![]() Pneumopathie interstitielle diffuse illustrant une des manifestations extraarticulaires graves de la polyarthrite rhumatoïde à la phase d’état.
Pneumopathie interstitielle diffuse illustrant une des manifestations extraarticulaires graves de la polyarthrite rhumatoïde à la phase d’état.
A. Pneumonie interstitielle commune. B. Pneumonie interstitielle non spécifique.
Complications cardiovasculaires
![]() La PR est surtout associée à une augmentation de la morbi-mortalité cardiovasculaire, avec un surrisque de maladie coronarienne ou d’accident vasculaire cérébral de l’ordre de 50 % comparativement à la population générale, comparable à celui observé au cours du diabète de type 2. Cette augmentation de la morbi-mortalité cardiovasculaire traduit d’une part la surreprésentation de certains facteurs de risque cardiovasculaire traditionnels (tabagisme et diabète de type 2 notamment), d’autre part les conséquences cardiovasculaires de l’inflammation chronique se traduisant par une athérosclérose accélérée, enfin l’impact cardiovasculaire péjoratif de la corticothérapie générale.
La PR est surtout associée à une augmentation de la morbi-mortalité cardiovasculaire, avec un surrisque de maladie coronarienne ou d’accident vasculaire cérébral de l’ordre de 50 % comparativement à la population générale, comparable à celui observé au cours du diabète de type 2. Cette augmentation de la morbi-mortalité cardiovasculaire traduit d’une part la surreprésentation de certains facteurs de risque cardiovasculaire traditionnels (tabagisme et diabète de type 2 notamment), d’autre part les conséquences cardiovasculaires de l’inflammation chronique se traduisant par une athérosclérose accélérée, enfin l’impact cardiovasculaire péjoratif de la corticothérapie générale.
Elle impose d’évaluer et de contrôler au mieux les facteurs de risque cardiovasculaire traditionnels par un dépistage régulier. La PR est considérée comme un facteur de risque cardiovasculaire indépendant. La rémission ou de faibles niveaux d’activité de la maladie permettent de réduire le risque cardiovasculaire.
Cancers
La PR est associée à un surrisque de lymphomes, qui seraient deux fois plus fréquents que dans la population générale. Le risque de lymphome concerne particulièrement les PR les plus actives et les plus sévères. Il s’agit principalement de lymphomes malins non hodgkiniens, de localisation ganglionnaire ou extraganglionnaire, développés à partir de cellules B matures (lymphomes diffus à grandes cellules B).
Le risque de cancers bronchopulmonaires semble plus élevé dans la PR que dans la population générale, vraisemblablement en raison d’une plus grande prévalence du tabagisme.
Infections
La PR est associée à une augmentation du risque d’infections, en relation avec la maladie mais aussi avec l’utilisation des csDMARD, des glucocorticoïdes et des traitements ciblés. La plupart des infections sont des infections bénignes, concernant principalement les voies aériennes supérieures, les voies urinaires et le revêtement cutané. Le risque d’infections sévères est majoré chez les patients traités par traitements ciblés comparativement à ceux recevant uniquement des csDMARD. Ce surrisque infectieux impose une évaluation individuelle du risque infectieux avant toute décision thérapeutique, une mise à jour systématique des vaccinations conformément au calendrier vaccinal, ainsi que des mesures de prévention spécifiques telles qu’une antibioprophylaxie antituberculeuse chez les patients à risque de tuberculose avant l’initiation d’un biomédicament.
Ostéoporose
La PR est associée à un risque accru d’ostéoporose, liée à la fois à l’inflammation systémique et à l’utilisation de corticoïdes.
![]() La diminution de l’espérance de vie des patients atteints de PR serait en moyenne de 5 à 10 ans par rapport à la population générale, particulièrement chez les patients ayant les formes les plus actives et les plus sévères de la maladie. Cette surmortalité s’explique en premier lieu par l’augmentation du risque cardiovasculaire, puis des infections et des cancers. Enfin, la présence d’une pneumopathie interstitielle grève également le pronostic vital.
La diminution de l’espérance de vie des patients atteints de PR serait en moyenne de 5 à 10 ans par rapport à la population générale, particulièrement chez les patients ayant les formes les plus actives et les plus sévères de la maladie. Cette surmortalité s’explique en premier lieu par l’augmentation du risque cardiovasculaire, puis des infections et des cancers. Enfin, la présence d’une pneumopathie interstitielle grève également le pronostic vital.
Les stratégies thérapeutiques actuelles, visant la rémission, faisant appel à des combinaisons de csDMARD (notamment le méthotrexate) et de traitements ciblés (notamment les anti-TNF) pourraient permettre une diminution de la surmortalité, notamment cardiovasculaire, chez les patients répondeurs comme cela a été suggéré dans certains registres de patients atteints de PR.
![]() Le rhumatologue coordonne la prise en charge thérapeutique des patients atteints de PR et en assure le suivi conjointement avec le médecin généraliste, qui joue un rôle central dans la coordination du parcours personnalisé de soins et dans la prise en charge des comorbidités.
Le rhumatologue coordonne la prise en charge thérapeutique des patients atteints de PR et en assure le suivi conjointement avec le médecin généraliste, qui joue un rôle central dans la coordination du parcours personnalisé de soins et dans la prise en charge des comorbidités.
Une prise en charge globale et multidisciplinaire doit être proposée au patient atteint de PR par le rhumatologue, intégrant traitements médicamenteux et thérapeutiques non médicamenteuses, adaptées individuellement à chaque patient, avec :
Le rhumatologue doit prendre le temps nécessaire pour délivrer l’information au patient à un rythme et sous une forme adaptée à sa capacité à recevoir et à assimiler cette information.
L’information sur la prise en charge thérapeutique doit être aussi complète que possible et insister sur le rapport bénéfice-risque du traitement médicamenteux et sur l’importance de l’observance du traitement prescrit.
Elle comporte notamment :
L’adhésion thérapeutique du patient est recherchée après lui avoir expliqué le rapport bénéfice-risque du traitement de fond et/ou de la corticothérapie et/ou du traitement symptomatique.
Les autres acteurs médicaux, paramédicaux, sociaux peuvent être présentés si le contexte clinique et socioprofessionnel le justifie.
Il est recommandé d’informer le médecin généraliste, les autres médecins spécialistes et les autres professionnels de santé concernés, afin d’organiser le suivi conjoint du patient. L’information doit porter sur le diagnostic et les modalités de prise en charge médicale et globale du patient.
Objectifs de la prise en charge thérapeutique
Par ailleurs, ces objectifs doivent être maintenus en l’absence de corticothérapie.
Un suivi serré et un traitement jusqu’à la cible (« tight control » & « treat to target »)
Le suivi du patient doit être fréquent (1 à 3 mois) tant que la maladie est active. S’il n’y a pas d’amélioration dans les 3 mois suivant le début du traitement de fond ou si l’objectif thérapeutique n’a pas été atteint à 6 mois, il faut réaliser un ajustement thérapeutique (initiation d’un traitement de fond de deuxième ligne en monothérapie ou combiné au méthotrexate, initiation ou ajustement d’une corticothérapie générale à faible dose, réalisation d’infiltrations intra-articulaires de glucocorticoïdes, ajustement du traitement symptomatique par AINS et/ou antalgiques).
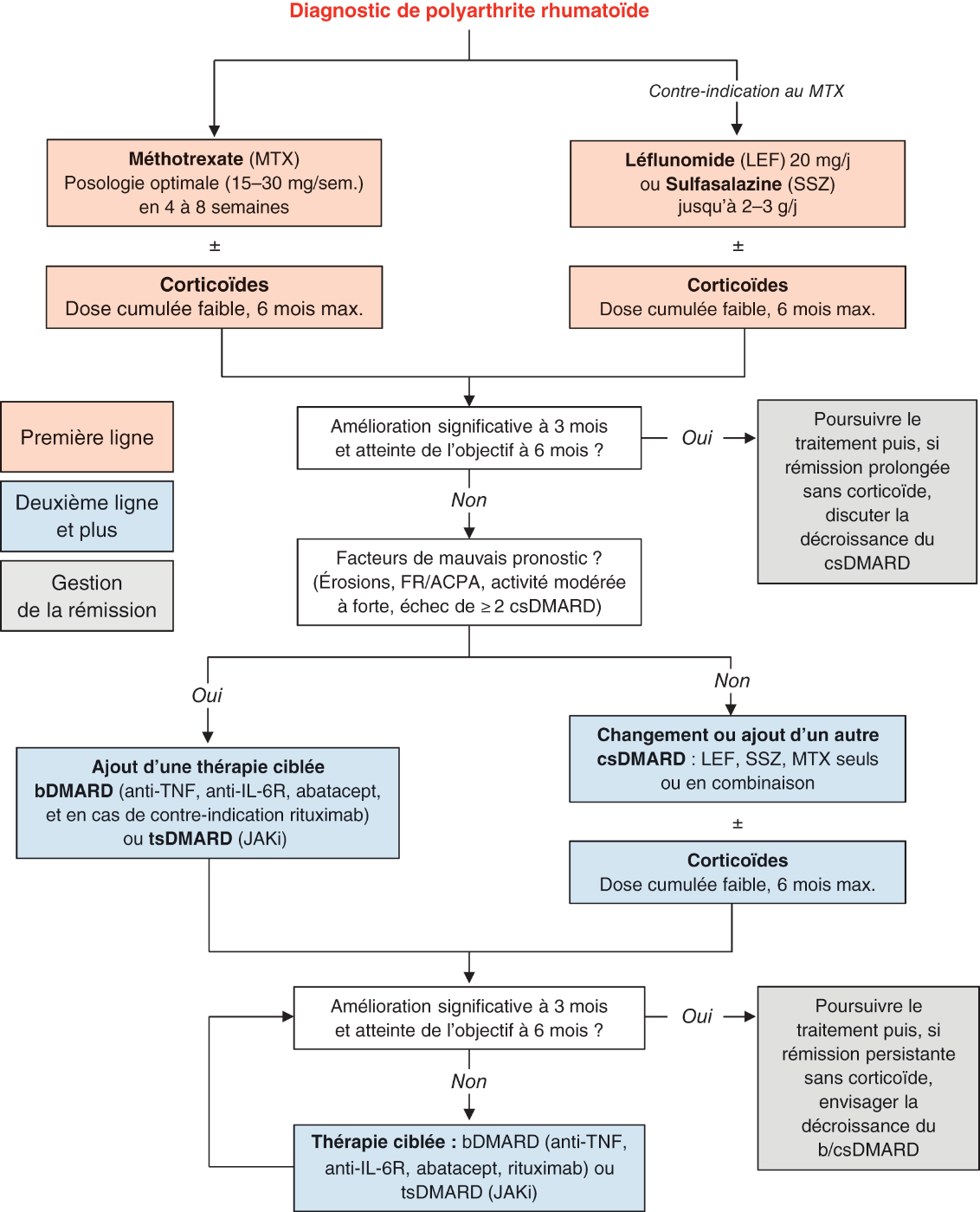
Il est recommandé d’instaurer le plus précocement possible un traitement de fond chez un patient ayant une polyarthrite persistante dont le diagnostic de PR a été confirmé par un rhumatologue (fig. 17.10). Le traitement de fond vise à prévenir l’évolution de la maladie, les lésions structurales et le handicap. Il a néanmoins un délai d’action de plusieurs semaines. Ainsi, son efficacité sera évaluée 2 à 3 mois après son initiation.
En première intention, en l’absence de contre-indication et en tenant compte des mises en garde spéciales et précautions d’emploi, il est recommandé d’initier un traitement de fond par méthotrexate, qui est le csDMARD de référence dans la PR (encadré 17.3).
Fig. 17.10. ![]() Algorithme de prise en charge de la PR selon les recommandations de 2018 de la Société française de rhumatologie.
Algorithme de prise en charge de la PR selon les recommandations de 2018 de la Société française de rhumatologie.
Source : Daien C, Hua C, Gaujoux-Viala C, et al. Update of French Society for Rheumatology Recommendations for Managing Rheumatoid Arthritis. Joint Bone Spine 2019;86(2):135–50.
Encadré 17.3. Modalités d’instauration et de surveillance du méthotrexate dans la polyarthrite rhumatoïde
Place du méthotrexate dans la stratégie thérapeutique de la PR
![]() Traitement de fond synthétique conventionnel (csDMARD) de première ligne chez les patients ayant une PR active.
Traitement de fond synthétique conventionnel (csDMARD) de première ligne chez les patients ayant une PR active.
Principales contre-indications du méthotrexate
Examens et mesures de sécurité recommandés avant l’instauration ou la réintroduction du méthotrexate
Posologie et mode d’administration
Examens et mesures de sécurité recommandés pendant le traitement (surveillance mensuelle durant les 3 premiers mois, puis toutes 4 à 12 semaines)
![]() Le méthotrexate a démontré son efficacité sur le contrôle de l’activité de la maladie et sa capacité à réduire la progression des lésions structurales dans la PR. Il a été utilisé comme traitement de référence et combiné aux bDMARD ou aux JAKi dans le cadre du développement de ces agents thérapeutiques dans la PR. Il a démontré un impact positif sur la réduction de la surmortalité globale et cardiovasculaire des patients atteints de PR. Sa tolérance est relativement bonne. Son coût est modéré.
Le méthotrexate a démontré son efficacité sur le contrôle de l’activité de la maladie et sa capacité à réduire la progression des lésions structurales dans la PR. Il a été utilisé comme traitement de référence et combiné aux bDMARD ou aux JAKi dans le cadre du développement de ces agents thérapeutiques dans la PR. Il a démontré un impact positif sur la réduction de la surmortalité globale et cardiovasculaire des patients atteints de PR. Sa tolérance est relativement bonne. Son coût est modéré.
D’autres traitements de fond, ayant fait la preuve de leur efficacité sur le contrôle de l’activité de la maladie et la réduction de la progression des lésions structurales dans la PR, peuvent être proposés en alternative au méthotrexate, en cas de contre-indication, de précaution d’emploi ou d’intolérance précoce au méthotrexate (cf. fig. 17.10) :
![]() Chez les patients insuffisamment répondeurs ou intolérants au méthotrexate (cf. fig. 17.10) :
Chez les patients insuffisamment répondeurs ou intolérants au méthotrexate (cf. fig. 17.10) :
![]() Les bDMARD ayant l’autorisation de mise sur le marché (AMM) dès la deuxième ligne ou en lignes ultérieures sont les anti-TNF (
Les bDMARD ayant l’autorisation de mise sur le marché (AMM) dès la deuxième ligne ou en lignes ultérieures sont les anti-TNF ( ![]() adalimumab, certolizumab pégol, étanercept, golimumab, infliximab ),
adalimumab, certolizumab pégol, étanercept, golimumab, infliximab ), ![]() les anti-IL-6R (
les anti-IL-6R ( ![]() sarilumab et tocilizumab )
sarilumab et tocilizumab ) ![]() et le CTLA4-Ig (abatacept), alors que l’anti-CD20 (
et le CTLA4-Ig (abatacept), alors que l’anti-CD20 ( ![]() rituximab)
rituximab) ![]() a une AMM dès la deuxième ligne. Les JAKi ayant l’AMM dès la deuxième ligne ou en lignes ultérieures sont des inhibiteurs sélectifs et réversibles de JAK1/JAK2 (
a une AMM dès la deuxième ligne. Les JAKi ayant l’AMM dès la deuxième ligne ou en lignes ultérieures sont des inhibiteurs sélectifs et réversibles de JAK1/JAK2 ( ![]() baricitinib)
baricitinib) ![]() ou JAK1/JAK3 (
ou JAK1/JAK3 ( ![]() tofacitinib ) ou JAK1 (
tofacitinib ) ou JAK1 ( ![]() upadacitinib, filgotinib).
upadacitinib, filgotinib).![]() Les bDMARD et les JAKi doivent préférentiellement être associés au méthotrexate et leur utilisation en monothérapie doit être réservée aux situations d’intolérance au méthotrexate ou lorsque la poursuite du traitement par méthotrexate est inadaptée (tableau 17.2).
Les bDMARD et les JAKi doivent préférentiellement être associés au méthotrexate et leur utilisation en monothérapie doit être réservée aux situations d’intolérance au méthotrexate ou lorsque la poursuite du traitement par méthotrexate est inadaptée (tableau 17.2).
![]() Les traitements symptomatiques visent à soulager rapidement les symptômes en attendant que le traitement de fond soit efficace.
Les traitements symptomatiques visent à soulager rapidement les symptômes en attendant que le traitement de fond soit efficace.
Anti-inflammatoires non stéroïdiens
Les AINS sont des traitements symptomatiques utiles par leurs effets anti-inflammatoire et antalgique : diminution des douleurs et des gonflements articulaires, pas d’impact significatif sur CRP (et VS), pas d’impact sur la progression des lésions radiographiques. La prescription d’un AINS chez un patient atteint de PR ne doit pas déroger aux règles de bon usage des AINS (cf. item 330 au chapitre 29).
Glucocorticoïdes par voie générale ou locale
Dans l’attente de l’efficacité du traitement de fond, une corticothérapie à faible dose peut être proposée, sur une période de moins de 6 mois. Cette corticothérapie est habituellement prescrite par voie orale, en monoprise matinale, faisant appel à de la prednisone, de la prednisolone ou de la méthylprednisolone. La posologie initiale se situe habituellement autour de 10 mg par jour d’équivalent prednisone, avec une diminution aussi rapide que possible, jusqu’à l’obtention de la dose minimale efficace se situant autour de 5 mg par jour d’équivalent prednisone, en vue d’un sevrage dans les 3 à 6 mois, dès que la PR est contrôlée par le traitement de fond.
La décision d’initier une corticothérapie générale nécessite l’évaluation individuelle de la balance bénéfice-risque chez chaque patient et la prévention des effets indésirables en particulier cardiovasculaires (dépistage et prise en charge des facteurs de risque cardiovasculaire traditionnels) et osseux (évaluation du risque fracturaire et traitement antiostéoporotique).
Les infiltrations intra-articulaires de corticoïdes constituent une alternative à l’initiation d’une corticothérapie par voie orale, tout en améliorant localement les symptômes de l’inflammation articulaire, avec moins d’effets secondaires à long terme au vu d’une plus faible dose cumulée. ![]() Les produits retard sont préférés, notamment l’hexacétonide de triamcinolone.
Les produits retard sont préférés, notamment l’hexacétonide de triamcinolone.
![]() La réadaptation fonctionnelle fait partie intégrante du traitement de la PR, en complément du traitement médicamenteux. Les indications de la réadaptation fonctionnelle concernent plus la PR établie que dans les formes débutantes de la maladie qui ont été transformées par les avancées thérapeutiques médicamenteuses.
La réadaptation fonctionnelle fait partie intégrante du traitement de la PR, en complément du traitement médicamenteux. Les indications de la réadaptation fonctionnelle concernent plus la PR établie que dans les formes débutantes de la maladie qui ont été transformées par les avancées thérapeutiques médicamenteuses.
Elle a pour objectifs de limiter ou de prévenir les déformations, d’entretenir et d’améliorer la trophicité musculaire, la mobilité articulaire et de lutter contre l’enraidissement. Elle comporte l’éducation du malade et la rééducation proprement dite. Dans certaines formes sévères, elle sera complétée par la réalisation d’appareillages (orthèses de repos et de correction pour les mains, les genoux, les chevilles, orthèses plantaires).
Traitement chirurgical
La chirurgie faisait partie intégrante du traitement de la PR, en complément du traitement médicamenteux. Ses indications sont moins fréquentes à l’heure actuelle qu’elles ne l’étaient avant les avancées thérapeutiques médicamenteuses. Elles sont discutées avec le patient, idéalement dans le cadre de consultations médico-chirurgicales réunissant le rhumatologue et le chirurgien orthopédiste. Il s’agit d’une chirurgie fonctionnelle visant à rétablir une fonction défaillante et à apporter l’indolence.
Les synovectomies et les ténosynovectomies (poignets), les arthrodèses (poignets, arrière-pieds) et les arthroplasties prothétiques (épaules, coudes, hanches, genoux) sont les interventions chirurgicales les plus utilisées.
![]() En cas de rémission persistante, sur une période d’au moins 6 mois, on peut envisager un allégement thérapeutique progressif.
En cas de rémission persistante, sur une période d’au moins 6 mois, on peut envisager un allégement thérapeutique progressif.
Nous rappelons que la corticothérapie orale devra être progressivement diminuée et arrêtée au maximum dans les 6 mois suivant son initiation et ceci, donc, avant toute décroissance des traitements de fond.
Toute décision de décroissance du traitement de fond doit être prise dans le cadre d’une décision médicale partagée avec le patient. Une stratégie de décroissance du traitement ciblé (réduction de dose ou espacement des injections) ou du traitement de fond conventionnel (csDMARD) est préférable à une tentative d’arrêt brutal, qui expose à un risque de reprise évolutive de la PR, pouvant s’accompagner d’une progression des lésions structurales.
![]() Au cours de la première année de la PR et jusqu’à l’atteinte de l’objectif de rémission ou de faible niveau d’activité de la maladie, on peut recommander une évaluation tous les 1 à 3 mois. Au-delà de la première année de la PR et lorsque l’objectif est atteint de façon persistante, on peut recommander une évaluation tous les 3 à 6 mois.
Au cours de la première année de la PR et jusqu’à l’atteinte de l’objectif de rémission ou de faible niveau d’activité de la maladie, on peut recommander une évaluation tous les 1 à 3 mois. Au-delà de la première année de la PR et lorsque l’objectif est atteint de façon persistante, on peut recommander une évaluation tous les 3 à 6 mois.
Le suivi clinique des patients doit comporter l’évaluation systématique :
Le suivi biologique du patient contribue à l’évaluation de l’activité de la maladie, au dépistage ou au suivi de certains événements indésirables induits par les traitements de la PR, au dépistage ou au suivi de certaines manifestations extra-articulaires et de certaines comorbidités. Il comporte notamment des contrôles réguliers :
Le suivi radiographique du patient comporte des radiographies des mains, des pieds et des autres articulations inflammatoires, tous les 6 mois au cours de la première année, puis tous les ans au cours des trois premières années, la périodicité des contrôles étant ensuite adaptée en fonction de l’atteinte de l’objectif thérapeutique de rémission ou de faible niveau d’activité de la maladie et des dommages structuraux préexistants.
Légende :
Dans le respect de la Réforme du deuxième cycle des études médicales (R2C), les connaissances rassemblées sur ce site sont hiérarchisées en rang A, rang B et rang C à l'aide de balises et d'un code couleur :
![]() Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
![]() Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
![]() Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).
